Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terbentuk dari penggunaan bersama-sama pasangan elektron yang berasal dari kedua atom yang berikatan.
A. Ciri-ciri Ikatan Kovalen
- Ikatan antara atom-atom yang cenderung melepas elektron (golongan IVA, VA, VIA dan VIIA)
- Ikatan antara sesama atom nonlogam
- Kedua atom memiliki selisih nilai keelektronegatifan kecil
- Memiliki ikatan yang lemah
- Umumnya tidak dapat menghantarkan listrik, kecuali beberapa senyawa kovalen polar dalam bentuk larutan
B. Ikatan Kovalen (Duplet dan Oktet)
Ikatan kovalen yang mengikuti kaidah duplet atau oktet pada atom pusatnya.
Contohnya ikatan pada molekul \(\ce{H2}\)
Ikatan antara 2 atom hidrogen merupakan ikatan kovalen, dimana masing-masing atom hidrogen menyumbang 1 elektron untuk digunakan secara bersama-sama.
Konfigurasi atom H: \(\ce{_1 H: 1}\)
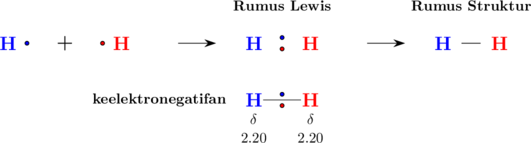
Terdapat 1 pasang elektron terikat antara 2 atom hidrogen dan mencapai kondisi stabil (duplet)
Elektron yang digunakan bersama terletak tepat di tengah di antara kedua atom hidrogen. Kondisi ini disebut ikatan kovalen nonpolar.
C. Ikatan Kovalen Non Oktet
Beberapa unsur yang tidak mengikuti kaidah oktet namun tetap dapat membentuk ikatan kovalen adalah Boron (B), Fosfor (P), Sulfur (S) dan Xenon (Xe).
Contohnya, ikatan pada molekul \(\ce{BF3}\)
Ikatan antara unsur boron dan fluorin merupakan ikatan kovalen, dimana 1 atom boron menyumbang 3 elektron dan 3 atom fluorin menyumbang masing-masing 1 elektron untuk digunakan secara bersama-sama.
Konfigurasi atom B
\(\ce{_5 B: 2 \quad 3}\)
Konfigurasi atom F
\(\ce{_{9} F: 2 \quad 7}\)
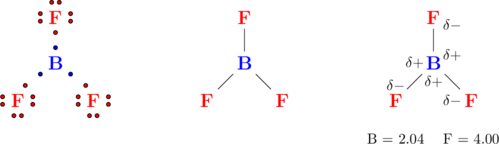
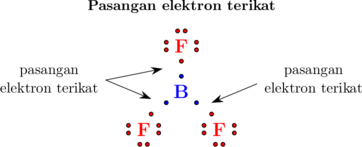
Atom B memiliki 3 elektron pada kulit terluarnya, dimana ketiganya dibagi untuk 3 atom F masing-masing 1 elektron. Sehingga pada atom B (atom pusat) memiliki 3 pasang elektron terikat.
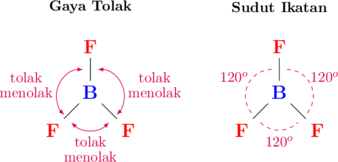
Di antara pasangan elektron terjadi gaya tolak menolak karena memiliki jenis muatan yang sama (elektron bermuatan negatif). Pada ikatan \(\ce{BF3}\), tiga pasang elektron terikat saling tolak menolak. Akibat gaya tolak menolak ini, pasangan elektron terikat saling menjauh satu sama lain. Sudut yang terbentuk di antara pasangan elektron terikat tersebut adalah 120°.
Ikatan antara B dan F adalah ikatan polar (memiliki nilai keelektronegatifan yang berbeda), namun molekul \(\ce{BF3}\) secara keseluruhan merupakan ikatan nonpolar. Hal ini dikarenakan keelektronegatifan pada ketiga atom F sama besar.

D. Ikatan Kovalen Koordinat
Ikatan kovalen biasa adalah penggunaan bersama-sama pasangan elektron yang berasal dari kedua atom.
Ikatan kovalen koordinat adalah penggunaan bersama-sama pasangan elektron yang berasal dari salah satu atom saja.
Contohnya ikatan pada molekul \(\ce{SO2}\)
Konfigurasi atom S
\(\ce{_16 S: 2 \quad 8 \quad 6}\)
Konfigurasi atom O
\(\ce{_{8} O: 2 \quad 6}\)
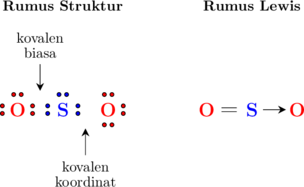
Atom O dengan 6 elektron valensi membutuhkan 2 elektron tambahan untuk mencapai kondisi oktet dan untuk itu menggunakan 2 elektron milik atom S.
Atom S dengan 6 elektron valensi juga membutuhkan 2 elektron tambahan, dan dapat menggunakan 2 elektron dari atom O (2 elektron tersebut berasal dari salah satu atom O).
Maka elektron yang digunakan bersama-sama hanya berasal dari salah satu atom O (bisa atom O di sebelah kiri atau sebelah kanan), dan pasangan elektron lainnya disebut kovalen koordinat.
Kovalen koordinat dilambangkan dengan tanda → mengarah kepada atom yang menggunakan elektron tersebut.
Ikatan pada atom pusat S terdiri atas 2 pasang elektron terikat dan 1 pasang elektron bebas. Pasangan elektron bebas memiliki gaya tolak yang lebih besar sehingga mendorong kedua pasangan elektron terikat sehingga membentuk sudut 119°.

Bentuk molekul seperti di atas menyebabkan molekul bersifat polar.
SOAL LATIHAN
