Sel Volta
Sel Volta merupakan rangkaian dari dua unsur yang bereaksi secara spontan dan menghasilkan energi listrik. Energi listrik dihasilkan karena perbedaan nilai potensial reduksi (Eº) dari masing-masing unsur yang bereaksi.
Contoh:
Sel Volta yang tersusun dari \(\ce{Ag}\) (Eº = +0,80 V) dan \(\ce{Zn}\) (Eº = −0,76 V)
Saat logam \(\ce{Ag}\) dihubungan dengan logam \(\ce{Zn}\), akan terjadi reaksi spontan dimana logam \(\ce{Ag}\) akan mengalami reduksi (Eº lebih besar) dan logam \(\ce{Zn}\) akan mengalami oksidasi (Eº lebih kecil). Reaksi tersebut akan membentuk sel volta, dimana potensial sel yang dihasilkan adalah selisih antara potensial reduksi \(\ce{Ag}\) dan \(\ce{Zn}\), yaitu 1,56 V (0,8 − (−0,76)).
Potensial Sel
\(\bbox[5px, border: 2px solid red] {\text{E}_{\text{sel}} = \text{E}^\text{o}_{\text{reduksi}} - \text{E}^\text{o}_{\text{oksidasi}}}\)
Reaksi Pada Sel Volta
Reaksi pada Anode (Oksidasi)
\(\ce {Zn (s) -> Zn^{2+} (aq) + 2e \quad E^{\text{o}} = + 0,76 V}\)
Reaksi pada Katode (Reduksi)
\(\ce {Ag^+ (aq) + e -> Ag (s) \quad \:\: E^{\text{o}} = + 0,8 V}\)
Reaksi lengkap
\begin{align*} \begin{array} {lll} \ce {Zn (s) & -> Zn^{2+} (aq) + 2e \quad & E^{\text{o}} = + 0,76 V} \\\\ \ce {Ag^+ (aq) + e & -> Ag (s) \quad & E^{\text{o}} = + 0,8 V} \quad {\color {blue} \times 2} \\\\ \hline \\ \ce {Zn (s) + 2 Ag^+ (aq) & -> Zn^{2+} (aq) + 2 Ag (s) & E^{\text{o}} = +1,56 V} \end{array} \end{align*}
Notasi sel: \(\ce{Zn | Zn^{2+} || Ag+ | Ag \quad E^{\text{o}} = +1,56 V } \)
Rangkaian Sel Volta
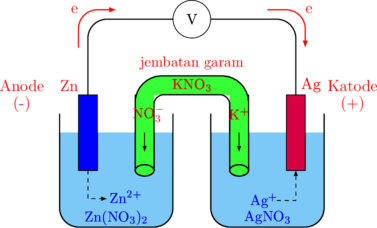
Rangkaian terdiri atas:
-
- Keping anode \(\ce{(Zn)}\) pada kutub negatif
- Keping katode \(\ce{(Ag)}\) pada kutub positif
- Larutan \(\ce{Zn(NO3)2}\)
- Larutan \(\ce{AgNO3}\)
- \(\ce{KNO3}\) sebagai jembatan garam
Proses Reaksi dan Hasil Akhir
Reaksi pada Anode
\(\ce{Zn}\) mengalami oksidasi dengan melepaskan elektron dan membentuk ion \(\ce{Zn^{2+}}\).
Elektron yang dilepaskan akan mengalir melalui kawat penghantar menuju keping katode (\(\ce{Ag}\)).
Ion \(\ce{Zn^{2+}}\) akan larut dalam larutan \(\ce{Zn(NO3)2}\).
Hasil akhir: keping \(\ce{Zn}\) akan berkurang dan ion \(\ce{Zn^{2+}}\) akan bertambah banyak.
Karena ion positif \(\ce{Zn^{2+}}\) bertambah banyak, larutan akan dinetralkan oleh ion \(\ce{NO3-}\) yang berasal dari jembatan garam.
Reaksi pada Katode
\(\ce{Ag}\) mengalami reduksi dengan menerima elektron melalui kawat penghantar.
Elektron tersebut akan ditangkap oleh ion \(\ce{Ag+}\) yang berasal dari larutan \(\ce{AgNO3}\) akan membentuk \(\ce{Ag}\) solid.
Hasil akhir: keping \(\ce{Ag}\) akan bertambah berat dan ion \(\ce{Ag^{+}}\) akan berkurang.
Karena ion positif \(\ce{Ag+}\) berkurang, larutan akan dinetralkan oleh ion \(\ce{K+}\) yang berasal dari jembatan garam.
SOAL LATIHAN
