A. Reaksi Kesetimbangan
Reaksi kesetimbangan adalah reaksi yang berjalan dalam dua arah, dimana zat-zat hasil reaksi (produk) dapat bereaksi kembali membentuk zat sebelum reaksi (reaktan).
\(\ce{A + B <=> C}\)
Ciri-ciri reaksi kesetimbangan:
- reaksi berjalan dalam sistem tertutup
- bersifat reversible (reaksi berjalan dalam dua arah dengan laju reaksi yang sama)
- bersifat dinamis (reaksi berjalan terus walaupun posisi kesetimbangan sudah tercapai)
- bersifat mikroskopis
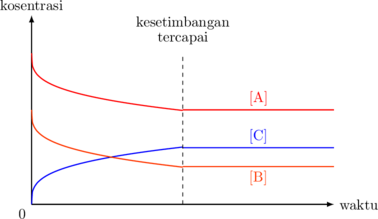
Grafik Konsentrasi vs Waktu
Grafik Laju Reaksi vs Waktu
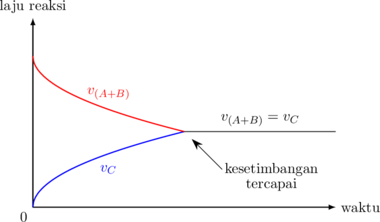
Mula-mula hanya ada zat A dan B. Dengan berjalannya reaksi, konsentrasi A dan B semakin berkurang, sehingga laju reaksinya bertambah kecil.
Sebaliknya untuk zat C, mula-mula belum ada. Dengan berjalannya reaksi, konsentrasi C bertambah banyak, sehingga laju reaksinya bertambah besar.
Pada suatu waktu, laju reaksi A dan B sama dengan laju reaksi C. Pada titik ini, posisi kesetimbangan tercapai, dan konsentrasi setiap zatnya tidak berubah.
B. Derajat Disosiasi
Derajat disosiasi (\(\alpha\)) adalah persentase jumlah zat yang terurai dibandingkan dengan jumlah zat mula-mula.
\(\alpha = \dfrac{\text{zat yang terurai}}{\text{zat mula-mula}}\)
Strategi pemecahan masalah
Jika dimisalkan jumlah zat mula-mula = \(a\), maka jumlah zat yang terurai = \(a \:.\: \alpha\)
\begin{equation*}
\begin{array}
& & \ce{A(g)} & \ce{<=>} & \ce {B(g)} & + & \ce{C(g)} \\\\
\text{Mula-mula} & a & & - & & - \\\\
\text{Reaksi} & a \: \alpha & & a \: \alpha & & a \: \alpha \\\\
\text{Akhir} & a(1 - \alpha) & & a \: \alpha & & a \: \alpha
\end{array}
\end{equation*}
C. Tetapan Kesetimbangan Kc
Pada reaksi:
\(\ce{p A(aq) + q B(l) <=> r C(g) + s D(s)}\)
Tetapan kesetimbangan berdasarkan konsentrasi zat adalah
\(K_c = \dfrac {[C]^r}{[A]^p}\)
Tetapan kesetimbangan berdasarkan konsentrasi hanya dihitung dari zat-zat berwujud larutan (aq) dan gas.
Nilai tetapan kesetimbangan tidak dipengaruhi oleh perubahan tekanan dan volume zat, namun dipengaruhi oleh perubahan suhu.
Kc dan Perubahan Suhu
Perhatikan reaksi di bawah ini:
\(\ce{A (g) + B (g) <=> C (g) \quad \Delta H = + 100 \text{ kJ}}\)
\(K_c = \dfrac {[C]}{[A] \: [B]}\)
Reaksi di atas menunjukkan bahwa reaksi ke arah kanan merupakan reaksi endoterm dan reaksi ke arah kiri merupakan reaksi eksoterm.
Saat suhu dinaikkan, reaksi akan bergeser ke arah endoterm (ke arah kanan) sehingga konsentrasi zat C akan bertambah dan konsentrasi zat A dan B akan berkurang, yang menyebabkan nilai Kc akan semakin besar.
Sebaliknya, saat suhu diturunkan, reaksi akan bergeser ke arah eksoterm (ke arah kiri) sehingga konsentrasi zat C akan berkurang dan konsentrasi zat A dan B akan bertambah, yang menyebabkan nilai Kc akan semakin kecil.
Menentukan Apakah Suatu Reaksi Sudah Mencapai Kesetimbangan
Diketahui suatu reaksi yang sedang berlangsung \(\ce{A (g) + B (g) <=> C (g) \quad Kc = K}\)
Pada suatu waktu, jumlah zat A, B dan C adalah [A], [B] dan [C]. Apakah pada saat ini zat-zat sudah berada dalam kesetimbangan?
Kita dapat menghitung nilai tetapan sementara \(Q_c = \dfrac {[C]}{[A] \: [B]}\)
(1) Jika \(Q_c = K_c\) maka reaksi sudah mencapai kesetimbangan.
(2) Jika \(Q_c < K_c\) maka reaksi belum mencapai kesetimbangan, nilai \(Q_c\) akan meningkat untuk mencapai nilai \(K_c\) sehingga reaksi masih berlangsung ke arah kanan.
(3) Jika \(Q_c > K_c\) maka reaksi belum mencapai kesetimbangan, nilai \(Q_c\) akan menurun untuk mencapai nilai \(K_c\) sehingga reaksi masih berlangsung ke arah kiri.
Kc dan Manipulasi Reaksi
Perhatikan reaksi di bawah ini:
1. Reaksi yang dibalik
\(\ce{A (g) + B (g) <=> C (g) \quad Kc = K}\)
\(\ce{C (g) <=> A (g) + B (g) \quad Kc = \dfrac {1}{K}}\)
2. Reaksi yang dikali n
\(\ce{A (g) + B (g) <=> C (g) \quad Kc = K}\)
\(\ce{n A (g) + n B (g) <=> n C (g) \quad Kc = K^n}\)
3. Dua reaksi yang dijumlahkan
\begin{equation*}
\begin{split}
\ce{A (g) + B (g) & <=> C (g) \quad Kc = K_1} \\\\
\ce{C (g) + D (g) & <=> E (g) \quad Kc = K_2} \quad (+) \\\\
\hline \\
\ce{A (g) + B (g) + D (g) & <=> E (g) \quad K_3 = K_1 \:.\: K_2}
\end{split}
\end{equation*}
D. Tetapan Kesetimbangan Kp
Pada reaksi:
\(\ce{p A(g) + q B(aq) <=> r C(g) + s D(s)}\)
Tetapan kesetimbangan berdasarkan konsentrasi zat adalah
\(K_p = \dfrac {[P_C]^r}{[P_A]^p}\)
Tetapan kesetimbangan berdasarkan tekanan hanya dihitung dari zat-zat berwujud gas.
E. Hubungan Kc Dan Kp
Hubungan antara nilai Kc dan Kp adalah
\(K_p = K_c \: (R \:.\: T)^{\Delta n}\)
R = 0,082
T = suhu dalam K = ºC + 273
\(\Delta n = \Sigma \text{(Koefisien reaksi produk}) - \Sigma \text{(Koefisien reaksi reaktan)}\)
F. Pergeseran Kesetimbangan
Le Chatelier's Principle:
Bila kondisi pada reaksi kesetimbangan berubah,
posisi kesetimbangan akan berubah untuk melawan perubahan kondisi tersebut
1. Perubahan konsentrasi zat
Saat konsentrasi A ditambah, reaksi bergeser ke arah sebaliknya
\(\ce{A(g) + 2 B(g) <=> C(g) + D(g)}\)
![]()
Saat konsentrasi A dikurangi, reaksi bergeser ke arah zat A
\(\ce{A(g) + 2 B(g) <=> C(g) + D(g)}\)
![]()
2. Perubahan tekanan
Saat tekanan diperbesar, reaksi bergeser ke arah jumlah koefisien terkecil
\(\ce{A(g) + 2 B(g) <=> C(g) + D(g)}\)
![]()
Saat tekanan diperkecil, reaksi bergeser ke arah jumlah koefisien terbesar
\(\ce{A(g) + 2 B(g) <=> C(g) + D(g)}\)
![]()
3. Perubahan volume
Karena volume berbanding terbalik dengan tekanan, maka pergeseran posisi kesetimbangan juga kebalikan dari tekanan.
Apabila volume diperbesar, posisi kesetimbangan akan bergeser ke arah dimana jumlah molekul (jumlah koefisien reaksi yang besar).
Sebaliknya, apabila volume diperkecil, posisi kesetimbangan akan bergeser ke arah dimana jumlah molekul (jumlah koefisien reaksi yang kecil).
4. Perubahan suhu
Suhu dinaikkan, reaksi akan bergeser ke arah endoterm
\(\ce{A(g) + 2 B(g) <=> C(g) + D(g)} \quad \Delta H = - 100 \text { kJ}\)
![]()
Suhu diturunkan, reaksi akan bergeser ke arah eksoterm
\(\ce{A(g) + 2 B(g) <=> C(g) + D(g)} \quad \Delta H = - 100 \text { kJ}\)
![]()
G. Katalis
Katalis adalah zat yang terlibat dalam suatu reaksi namun tidak mempengaruhi hasil akhir reaksi.
Katalis digunakan untuk:
-
- mempercepat laju reaksi
- membuat reaksi mungkin terjadi
Katalis tidak menggeser posisi kesetimbangan.
H. Proses Haber
Proses Haber merupakan proses industri pembuatan zat amonia dari gas nitrogen dan gas hidrogen.
\(\ce{N2(g) + 3 H2 (g) <=> 2 NH3(g)} \quad \Delta \text{H} = -92 \text{ kJ/mol}\)
Kondisi yang diperlukan dalam proses Haber:
-
- Menggunakan katalis \(\ce{Fe}\) dan \(\ce{KOH}\) untuk mempercepat reaksi dan efisiensi
- Tekanan sekitar 200 atm. Dengan tekanan besar, maka posisi kesetimbangan lebih banyak membentuk \(\ce{NH3}\)
- Suhu 400ºC − 450ºC
Berdasarkan prinsip Le Chatelier, suhu yang tinggi sesungguhnya akan menggeser posisi kesetimbangan ke arah kiri (mengurangi jumlah \(\ce{NH3}\)). Namun suhu yang tinggi diperlukan agar reaksi dapat berjalan lebih cepat. Jumlah optimal \(\ce{NH3}\) diperoleh pada suhu 400ºC − 450ºC.
Gas hidrogen murni didapat dari penguraian gas metana, sedangkan gas nitrogen didapat dari udara. Setelah gas amonia terbentuk, gas tersebut dialirkan ke tempat lain untuk didinginkan sehingga didapat amonia dalam wujud cair.
I. Proses Kontak
Proses Kontak merupakan proses dalam industri untuk pembuatan asam sulfat.
Proses kontak terdiri atas 3 tahap:
A. Pembuatan \(\ce{SO2}\)
Belerang dioksida dapat dibuat dengan 2 cara:
(1) \(\ce{S(s) + O2(g) -> SO2(g)}\)
(2) \(\ce{4 FeS2(s) + 11 O2(g) -> 2 Fe2O3(s) + 8 SO2(g)}\)
\(\ce{SO2}\) yang terbentuk digunakan untuk membuat \(\ce{SO3}\)
B. Pembuatan \(\ce{SO3}\)
\(\ce{SO2(g) + O2(g) <=> 2 SO3(g) \quad \Delta H = - 196 kJ}\) (reaksi kesetimbangan)
Kondisi yang dibutuhkan untuk reaksi di atas:
− Menggunakan katalis vanadium (V) oksida \(\ce{(V2O5)}\)
− Tekanan sekitar 1 − 2 atm. Dengan tekanan besar, maka posisi kesetimbangan lebih banyak membentuk \(\ce{SO3}\)
− Suhu 400ºC − 450ºC. Suhu yang tinggi akan mempercepat reaksi.
C. Pembuatan asam sulfat
Pembuatan asam sulfat dari \(\ce{SO3}\) membutuhkan asam sulfat awal untuk melarutkan \(\ce{SO3}\)
\(\ce{H2SO4(aq) + SO3(g) <=> H2S2O7(aq)}\)
\(\ce{H2S2O7(aq) + H2O(l) <=> 2 H2SO4(aq)}\)
\(\ce{H2SO4}\) yang dihasilkan dua kali lebih banyak daripada \(\ce{H2SO4}\) yang digunakan di saat awal.
