A. Laju Reaksi Penguraian Dan Pembentukan
Diketahui reaksi sebagai berikut:
\(\ce{A(g) -> B(g)}\)
Laju reaksi penguraian zat A
\(v_A = - \dfrac {\Delta [A]}{\Delta t}\)
\(\Delta [A]\) = perubahan konsentrasi zat A
\(\Delta t\) = selang waktu reaksi
Tanda (−) menunjukkan jumlah zat A yang berkurang saat reaksi berlangsung.
Laju reaksi pembentukan zat B
\(v_B = \dfrac {\Delta [B]}{\Delta t}\)
\(\Delta [B]\) = perubahan konsentrasi zat B
\(\Delta t\) = selang waktu reaksi
B. Faktor-faktor Yang Mempengaruhi Laju Reaksi
Teori Tumbukan
Reaksi dapat terjadi apabila terjadi tumbukan antar atom dan molekul dari zat-zat yang bereaksi. Semakin sering terjadi tumbukan, reaksi yang semakin cepat.
Faktor-faktor yang mempengaruhi laju reaksi:
(1) Konsentrasi
Semakin besar konsentrasi reaktan, semakin sering terjadi tumbukan antar atom dan molekul zat yang bereaksi, sehingga laju reaksi akan semakin cepat.
(2) Luas permukaan
Semakin besar luas permukaan, semakin sering terjadi tumbukan antar atom dan molekul zat yang bereaksi, sehingga laju reaksi akan semakin cepat.
Zat berbentuk serbuk memiliki luas permukaan lebih besar daripada bentuk bongkahan, sehingga laju reaksi zat berbentuk serbuk lebih cepat.
(3) Suhu
Semakin tinggi suhu, semakin besar energi kinetik yang dimiliki oleh atom dan molekul zat, sehingga akan semakin sering terjadi tumbukan dan laju reaksi semakin cepat.
(4) Katalis
Katalis yang sesuai dapat menurunkan energi aktivasi (energi yang dibutuhkan agar reaksi dapat berlangsung).
Dengan energi aktivasi yang rendah, reaksi dapat berlangsung lebih cepat.
C. Persamaan Laju Reaksi
Persamaan laju reaksi didapat dari data hasil percobaan.
\(\ce{A(g) + B(g) -> C(g)}\)
Persamaan laju reaksi:
\(v = k \:.\: [A]^x \:.\: [B]^y \)
\(x\) dan \(y\) adalah orde reaksi masing-masing zat.
Orde reaksi total = \(x + y\)
Grafik Laju Reaksi vs Konsentrasi
\(v = k \: [A]^0\)

\(v = k \: [A]^1\)

\(v = k \: [A]^2\)

\(v = k \: [A]^{-1}\)
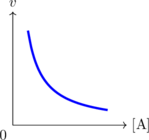
\(v = k \: [A]^{\frac 12}\)

D. Pengaruh Katalis Dalam Laju Reaksi
Katalis dapat mempercepat laju reaksi dengan cara memecah reaksi menjadi beberapa tahap.
