A. Potensial Reduksi Standar
Potensial reduksi standar (Eº) adalah kecenderungan suatu unsur menerima elektron (mengalami reduksi) pada suhu standar 25ºC dan tekanan 1 atm.
Nilai Eº yang dijadikan acuan adalah unsur hidrogen, yang memiliki nilai Eº = 0. Unsur-unsur lain yang lebih mudah mengalami reduksi dibandingan hidrogen memiliki nilai Eº > 0 (positif), sebaliknya unsur-unsur yang lebih sulit mengalami reduksi dibandingkan hidrogen memiliki nilai Eº < 0 (negatif).
Nilai Eº memiliki satuan Volt,
Gambar di bawah ini menunjukkan deretan unsur-unsur yang disusun dari nilai Eº terkecil hingga Eº terbesar.
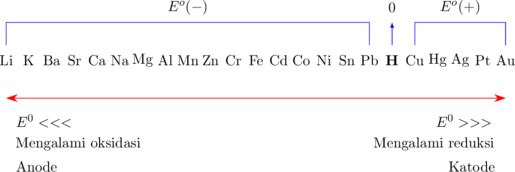
Dari gambar di atas dapat disimpulkan bahwa semakin besar nilai Eº, unsur semakin mudah mengalami reduksi (oksidator). Sebaliknya, semakin kecil nilai Eº, unsur semakin mudah mengalami oksidasi (reduktor).
Reaksi Spontan dan Tidak Spontan
Apabila dua unsur dihubungkan, reaksi akan terjadi secara spontan dimana unsur dengan nilai Eº lebih besar mengalami reduksi dan unsur dengan nilai Eº lebih kecil mengalami oksidasi.
Contoh:
Apabila logam Au (Eº = +1,69 V) dan Li (Eº = −3,04 V) dihubungkan, akan terjadi reaksi spontan dimana Au (Eº lebih besar) mengalami reduksi dan Li (Eº lebih kecil) mengalami oksidasi.
Reaksi yang tidak spontan (membutuhkan energi dari luar agar bisa bereaksi) terjadi sebaliknya, apabila unsur dengan nilai Eº lebih besar mengalami oksidasi dan unsur dengan nilai Eº lebih kecil mengalami reduksi.
Untuk lebih jelasnya, berikut perbedaan antara reaksi spontan dan reaksi tidak spontan:
| Reaksi Spontan | Reaksi Tidak Spontan |
| Reduksi: unsur dengan Eº lebih besar
Oksidasi: unsur dengan Eº lebih kecil |
Reduksi: unsur dengan Eº lebih kecil
Oksidasi: unsur dengan Eº lebih besar |
| Potensial sel yang dihasilkan bernilai positif
Reaksi menghasilkan energi |
Potensial sel yang dihasilkan bernilai negatif
Reaksi menyerap energi |
B. Sel Volta
Sel Volta merupakan rangkaian dari dua unsur yang bereaksi secara spontan dan menghasilkan energi listrik. Energi listrik dihasilkan karena perbedaan nilai potensial reduksi (Eº) dari masing-masing unsur yang bereaksi.
Sel Volta yang tersusun dari Ag (Eº = +0,80 V) dan Zn (Eº = −0,76 V)
Saat logam Ag dihubungan dengan logam Zn, akan terjadi reaksi spontan dimana logam Ag akan mengalami reduksi (Eº lebih besar) dan logam Zn akan mengalami oksidasi (Eº lebih kecil). Reaksi tersebut akan membentuk sel volta, dimana potensial sel yang dihasilkan adalah selisih antara potensial reduksi Ag dan Zn, yaitu 1,56 V (0,8 − (−0,76)).
Potensial Sel
\(\bbox[5px, border: 2px solid red] {\text{E}_{\text{sel}} = \text{E}^\text{o}_{\text{reduksi}} - \text{E}^\text{o}_{\text{oksidasi}}}\)
Reaksi Pada Sel Volta
Reaksi pada Anode (Oksidasi)
\(\ce {Zn (s) -> Zn^{2+} (aq) + 2e \quad E^{\text{o}} = + 0,76 V}\)
Reaksi pada Katode (Reduksi)
\(\ce {Ag^+ (aq) + e -> Ag (s) \quad \:\: E^{\text{o}} = + 0,8 V}\)
Reaksi lengkap
\begin{align*} \begin{array} {lll} \ce {Zn (s) & -> Zn^{2+} (aq) + 2e \quad & E^{\text{o}} = + 0,76 V} \\\\ \ce {Ag^+ (aq) + e & -> Ag (s) \quad & E^{\text{o}} = + 0,8 V} \quad {\color {blue} \times 2} \\\\ \hline \\ \ce {Zn (s) + 2 Ag^+ (aq) & -> Zn^{2+} (aq) + 2 Ag (s) & E^{\text{o}} = +1,56 V} \end{array} \end{align*}
Notasi sel: \(\ce{Zn | Zn^{2+} || Ag^ | Ag \quad E^{\text{o}} = +1,56 V } \)
Rangkaian Sel Volta
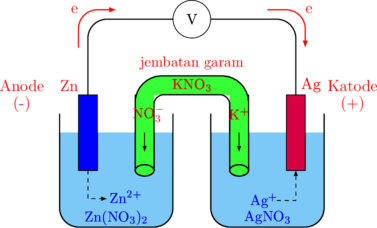
Rangkaian terdiri atas:
-
- Keping anode (Zn) pada kutub negatif
- Keping katode (Ag) pada kutub positif
- Larutan \(\ce{Zn(NO3)2}\)
- Larutan \(\ce{AgNO3}\)
- \(\ce{KNO3}\) sebagai jembatan garam
Proses Reaksi dan Hasil Akhir
Reaksi pada Anode
\(\ce{Zn}\) mengalami oksidasi dengan melepaskan elektron dan membentuk ion \(\ce{Zn^{2+}}\).
Elektron yang dilepaskan akan mengalir melalui kawat penghantar menuju keping katode (\(\ce{Ag}\)).
Ion \(\ce{Zn^{2+}}\) akan larut dalam larutan \(\ce{Zn(NO3)2}\).
Hasil akhir: keping Zn akan berkurang dan ion \(\ce{Zn^{2+}}\) akan bertambah banyak.
Karena ion positif \(\ce{Zn^{2+}}\) bertambah banyak, larutan akan dinetralkan oleh ion \(\ce{NO3-}\) yang berasal dari jembatan garam.
Reaksi pada Katode
\(\ce{Ag}\) mengalami reduksi dengan menerima elektron melalui kawat penghantar.
Elektron tersebut akan ditangkap oleh ion \(\ce{Ag+}\) yang berasal dari larutan \(\ce{AgNO3}\) akan membentuk \(\ce{Ag}\) solid.
Hasil akhir: keping Ag akan bertambah berat dan ion \(\ce{Ag^{+}}\) akan berkurang.
Karena ion positif \(\ce{Ag+}\) berkurang, larutan akan dinetralkan oleh ion \(\ce{K+}\) yang berasal dari jembatan garam.
C. Sel Elektrolisis
Reaksi elektrolisis merupakan reaksi redoks yang tidak spontan karena membutuhkan energi dari luar agar reaksi dapat terjadi.
Reaksi elektrolisis terjadi menurut ketentuan sebagai berikut:
REAKSI ELEKTROLISIS
| REAKSI PADA ANODE | |
|
Anode merupakan zat inert (C, Pt, Au) (A) Sisa asam oksi Air akan mengalami oksidasi. \(\ce {2 H2O(l) -> 4 H+(aq) + O2(g) + 4e}\)
(B) Sisa asam lain atau \(\ce {OH-}\) Sisa asam lain atau \(\ce {OH-}\) akan mengalami oksidasi. \(\ce {2 Cl-(aq) -> Cl2(g) + 2e}\) \(\ce {4 OH-(aq) -> 2 H2O(l) + O2(g) + 4e}\) |
Anode bukan merupakan zat inert Anode akan mengalami oksidasi. \(\ce {L(s) -> L^{x +} + x \: e}\) |
| REAKSI PADA KATODE | |
|
Kation logam aktif (golongan IA, IIA, Al atau Mn) Air akan mengalami reduksi. \(\ce {2 H2O(l) + 2e -> 2 OH-(aq) + H2(g) }\) |
Kation bukan logam aktif Kation akan mengalami reduksi. \(\ce {L^{x+}(aq) + x \: e -> L(s)}\) |

