Gaya Antar Molekul
Gaya antar molekul adalah gaya tarik-menarik di antara sesama molekul yang berdekatan. Gaya tarik-menarik tersebut menyebabkan molekul-molekul saling menyatu satu sama lain.
Gaya antar molekul dibedakan atas (dari paling lemah hingga paling kuat):
(A) Gaya Van Der Waals
(1) Dipol sesaat (gaya dispersi/gaya London)
(2) Dipol permanen
(B) Ikatan hidrogen
(C) Ikatan ion
(D) Jaringan molekul raksasa
Silika (SiO2), grafit (C) dan intan
Gaya antar molekul terkait erat dengan titik leleh dan titik didih molekul. Semakin besar gaya antar molekul, maka semakin besar juga titik leleh dan titik didih molekul tersebut. Hal ini dikarenakan dibutuhkan energi lebih yang melawan gaya antar molekul untuk memisahkan molekul-molekul tersebut.
A. Gaya Van der Waals: dipol sesaat
Interaksi dipol sesaat terjadi pada molekul-molekul dengan ikatan kovalen, misalnya gas hidrogen. Molekul gas hidrogen merupakan molekul nonpolar karena nilai keelektronegatifan yang sama, elektron-elektron berada tepat di tengah-tengah di antara kedua atom.
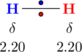
Saat elektron tepat berada di tengah-tengah, maka tidak ada polaritas pada molekul tersebut. Namun elektron bersifat "mobile", selalu bergerak dan berpindah tempat. Pada suatu waktu, elektron bisa berada lebih dekat ke salah satu atom, menyebabkan atom tersebut memiliki polaritas negatif dan atom yang lain memiliki polaritas positif.
![]()
Karena perbedaan polaritas pada molekul tersebut, molekul lain yang berada di dekatnya akan tertarik dengan polaritas yang berlawanan.
![]()
Perbedaan polaritas menyebabkan gaya tarik menarik antar molekul satu dengan molekul lainnya. Dan seterusnya terjadi pada semua molekul-molekul yang berdekatan.
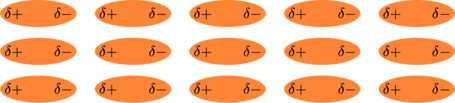
Karena elektron selalu berpindah tempat, maka polaritas antar molekul juga selalu berubah dan molekul-molekul melakukan penyesuaian (sinkronisasi).
Gaya dipol sesaat kadang disebut sebagai gaya dispersi, atau gaya London (dari nama penemunya Fritz London). Semua nama ini memiliki pengertian yang sama.
Dalam sistem periodik, semakin ke bawah (Mr semakin besar) gaya dipol sesaat juga semakin besar. Hal ini dikarenakan semakin ke bawah radius atom semakin besar dan jumlah elektron juga semakin banyak. Dengan demikian, peluang terjadinya dipol-dipol sesaat juga semakin sering terjadi.
Gaya dipol sesaat terjadi pada semua ikatan kovalen, baik molekul yang bersifat polar maupun nonpolar
B. Gaya Van der Waals: dipol permanen
Gaya dipol permanen secara khusus terjadi pada molekul-molekul yang bersifat polar. Contohnya molekul HCl.
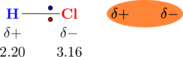
Perbedaan keelektronegatifan antara atom H dan atom Cl menyebabkan molekul memiliki polaritas yang berbeda. Perbedaan polaritas menyebabkan molekul-molekul lain di dekatnya akan terinduksi dan mengalami gaya tarik menarik.
Pada molekul kovalen polar, terdapat dua gaya antar molekul, yaitu gaya dipol sesaat (gaya London/gaya dispersi) dan gaya dipol permanen
Secara umum, gaya dipol sesaat lebih dominan (lebih besar) daripada gaya dipol permanen.
