Ikatan Hidrogen
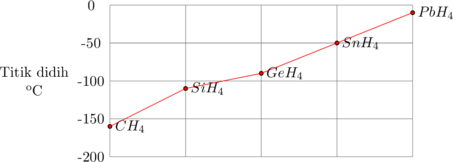
Semakin besar massa molekul relatif (Mr) suatu molekul, semakin tinggi titik didih molekul tersebut, sejalan dengan gaya dispersi (gaya London) yang semakin besar. Hal ini disebabkan karena radius atom yang semakin besar dan jumlah elektron yang semakin banyak akan memperbesar kemungkinan terjadinya dipol-dipol terinduksi.
Titik didih Golongan IVA
Titik didih Golongan VA. VIA dan VIIA
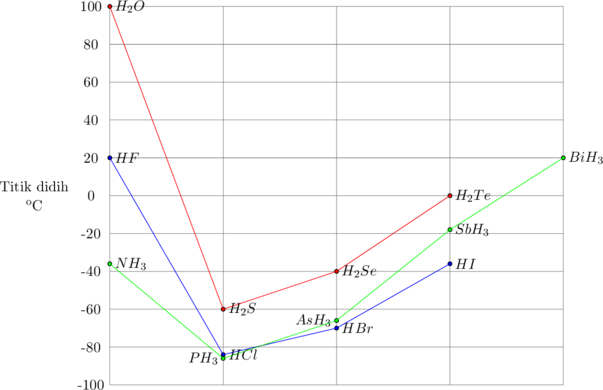
Pada golongan VA, VIA dan VIIA secara umum semakin ke bawah titik didih semakin meningkat sejalan dengan pertambahan Mr. Pengecualian terjadi pada senyawa NH3, H2O dan HF. Molekul-molekul NH3, H2O dan HF memiliki gaya antar molekul yang lebih besar, yang disebut ikatan hidrogen.
CONTOH
Molekul H2O memiliki polaritas δ− pada atom O dan polaritas δ+ pada atom H. Molekul H2O juga memiliki 2 pasang elektron bebas. Bila 2 molekul H2O saling berdekatan, δ+ hidrogen pada salah satu molekul akan tertarik oleh pasangan elektron bebas dari molekul yang lain.
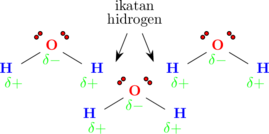
Molekul H2O memiliki 2 atom H dan 2 pasang elektron bebas, sehingga setiap molekul H2O dapat membentuk 2 ikatan hidrogen dengan 2 molekul H2O lainnya.
Demikian juga molekul HF yang memiliki 1 atom H dan 3 pasang elektron bebas, maka hanya 1 ikatan hidrogen yang terbentuk untuk setiap molekul HF.
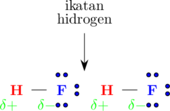
Molekul NH3 memiliki 3 atom H dan 1 pasang elektron bebas, sehingga hanya dapat membentuk 1 ikatan hidrogen untuk setiap molekul NH3.

