Ikatan Ion
A. Struktur Gas Mulia
Gas mulia merupakan unsur dengan kondisi yang paling stabil di antara unsur-unsur lainnya, berkaitan dengan struktur elektron pada kulit terluar (elektron valensi).
\(\ce{_2He: \:} \textcolor {red} {\ce {2}}\) → duplet
\(\ce{_10Ne: 2} \quad \textcolor {red} {\ce {8}}\) → oktet
\(\ce{_18Ar: 2 \quad 8} \quad \textcolor {red} {\ce {8}}\)
\(\ce{_36Kr: 2 \quad 8 \quad 18} \quad \textcolor {red} {\ce {8}}\)
\(\ce{_54Xe: 2 \quad 8 \quad 18 \quad 18} \quad \textcolor {red} {\ce {8}}\)
\(\ce{_86Rn: 2 \quad 8 \quad 18 \quad 32 \quad 18} \quad \textcolor {red} {\ce {8}}\)
Unsur-unsur lainnya dapat mencapai kondisi duplet atau oktet dengan cara melepas atau menerima elektron.
B. Ikatan Ion (Elektrovalen)
Suatu unsur dapat melepas elektron sehingga membentuk ion positif (kation). Elektron yang dilepas tersebut akan diterima oleh unsur lain yang membentuk ion negatif (anion). Kedua unsur tersebut akan membentuk ikatan yang disebut ikatan ion atau ikatan elektrovalen.
Unsur yang melepas elektron sehingga mencapai kondisi duplet atau oktet berada pada golongan IA, IIA dan IIIA (alumunium).
Sedangkan unsur yang menerima elektron sehingga berada pada kondisi oktet berada pada golongan VA, VIA dan VIIA.
Contoh:
Ikatan \(\ce{NaCl}\)
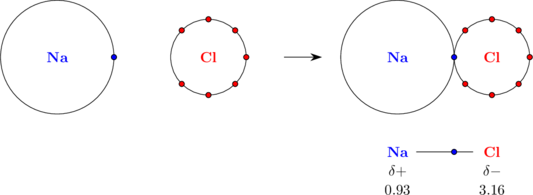
Ikatan antara unsur natrium dan klorin merupakan ikatan ion, dimana natrium akan melepas 1 elektron dan membentuk ion positif, sedangkan klorin akan menerima 1 elektron dan membentuk ion negatif.
Pembentukan ion \(\ce{Na^+}\) dan \(\ce{Cl^-}\)
\begin {array} {ll} & \ce{_{11} Na: 2 \quad 8} \quad {\textcolor {red} 1} \quad \quad \quad \ce{Na -> Na+ +} {\textcolor {red} e} \quad \quad \quad & \ce{Na+: 2 \quad 8} \\\\ & \ce{_{17} Cl: 2 \quad 8} \quad {\textcolor {blue} 7} \quad \quad \quad \ce{Cl +} {\textcolor {blue} e} \ce{-> Cl^-} \quad \quad \quad & \ce{Cl^-: 2 \quad 8} \quad {\textcolor {blue} 8} \end {array}
Satu elektron yang dilepas oleh atom Na akan diterima oleh atom Cl.
Reaksi antara atom Na dan Cl
\begin {array} {ll} & \ce{Na & -> Na+ +} {\textcolor {red} e} \\\\ & \ce{Cl +} {\textcolor {blue} e} & \ce{-> Cl^-} \quad \quad (+) \\ \hline \\ & \ce{Na + Cl & -> Na+ + Cl^-}\\\\ & \ce{Na + Cl & -> NaCl} \end {array}
Rumus Lewis NaCl
![]()
Perlu diperhatikan bahwa elektron yang dilepas oleh atom Na tidak sungguh-sungguh dilepaskan. Atom Na tidak kehilangan elektron tersebut, hanya elektron tersebut berada lebih dekat ke atom Cl. Elektron berada lebih dekat ke atom Cl karena unsur Cl memiliki keelektronegatifan lebih besar daripada unsur Na (Cl lebih negatif dan Na lebih positif).
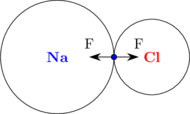
Elektron berada di antara atom Na dan atom Cl. Elektron tersebut mendapat gaya tarik dari inti atom Na dan inti atom Cl. Gaya tarik inti terhadap elektron ini yang membentuk ikatan antara atom Na dan atom Cl.
Letak elektron dalam orbital
\(\ce{^{}_{11}Na : [Ne] 3s^1}\)
![]()
\(\ce{^{}_{17}Cl : [Ne] 3s^2 3p^5}\)
![]()
Satu elektron \(\ce{Na}\) pada orbital \(\ce{3s}\) akan berpindah ke \(\ce{Cl}\) pada orbital \(\ce{3p^z}\) sehingga orbital pada ion \(\ce{Cl^-}\) menjadi:
![]()
C. Ikatan Ion Non Oktet
Beberapa unsur dapat membentuk ikatan ion walaupun tidak mencapai kondisi duplet/oktet. Misalnya:
\(\ce{Fe^{3+}: [Ar] 3d^5}\)
\(\ce{Cu^{2+}: [Ar] 3d^9}\)
\(\ce{Zn^{2+}: [Ar] 3d^{10}}\)
\(\ce{Ag^{+}: [Kr] 4d^{10}}\)
\(\ce{Pb^{2+}: [Xe] 4d^{14} 5d^{10} 6s^2}\)
D. Ciri-ciri Ikatan Ion
- Ikatan antara atom yang melepas elektron dan atom yang menerima elektron
- Ikatan antara atom logam dan nonlogam
- Kedua atom memiliki selisih nilai keelektronegatifan besar (umumnya memiliki selisih lebih dari 1,8)
- Memiliki ikatan yang sangat kuat
- Bersifat konduktor panas dan konduktor listrik dalam wujud padat dan cair
- Umumnya memiliki wujud padat pada suhu kamar (25°C), kecuali raksa memiliki wujud cair
SOAL LATIHAN
