Potensial Reduksi Standar
Potensial reduksi standar (Eº) adalah kecenderungan suatu unsur menerima elektron (mengalami reduksi) pada suhu standar 25ºC dan tekanan 1 atm.
Nilai Eº yang dijadikan acuan adalah unsur hidrogen, yang memiliki nilai Eº = 0. Unsur-unsur lain yang lebih mudah mengalami reduksi dibandingan hidrogen memiliki nilai Eº > 0 (positif), sebaliknya unsur-unsur yang lebih sulit mengalami reduksi dibandingkan hidrogen memiliki nilai Eº < 0 (negatif).
Nilai Eº memiliki satuan Volt,
Gambar di bawah ini menunjukkan deretan unsur-unsur yang disusun dari nilai Eº terkecil hingga Eº terbesar.
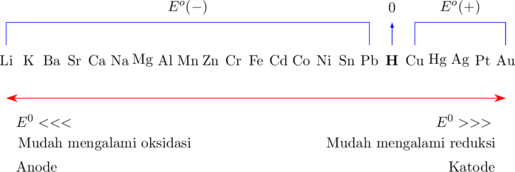
Dari gambar di atas dapat disimpulkan bahwa semakin besar nilai Eº, unsur semakin mudah mengalami reduksi (oksidator). Sebaliknya, semakin kecil nilai Eº, unsur semakin mudah mengalami oksidasi (reduktor).
Reaksi Spontan dan Tidak Spontan
Apabila dua unsur dihubungkan, reaksi akan terjadi secara spontan dimana unsur dengan nilai Eº lebih besar mengalami reduksi dan unsur dengan nilai Eº lebih kecil mengalami oksidasi.
Contoh:
Apabila logam Au (Eº = +1,69 V) dan Li (Eº = −3,04 V) dihubungkan, akan terjadi reaksi spontan dimana Au (Eº lebih besar) mengalami reduksi dan Li (Eº lebih kecil) mengalami oksidasi.
Reaksi yang tidak spontan terjadi sebaliknya. Unsur dengan nilai Eº lebih besar mengalami oksidasi dan unsur dengan nilai Eº lebih kecil mengalami reduksi. Reaksi tidak spontan membutuhkan energi dari luar agar bisa bereaksi.
Reaksi spontan akan dipelajari lebih lanjut pada Sel Elektrokimia dan reaksi tidak spontan pada Sel elektrolisis.
Untuk lebih jelasnya, berikut perbedaan antara reaksi spontan dan reaksi tidak spontan:
| Reaksi Spontan | Reaksi Tidak Spontan |
|---|---|
| Eº besar: reduksi
Eº kecil: oksidasi |
Eº besar: oksidasi
Eº kecil: reduksi |
| Potensial sel yang dihasilkan bernilai positif
Reaksi menghasilkan energi |
Potensial sel yang dihasilkan bernilai negatif
Reaksi menyerap energi |
SOAL LATIHAN
