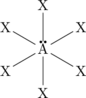
A. IKATAN ION
1. Struktur Gas Mulia
Gas mulia merupakan unsur dengan kondisi yang paling stabil di antara unsur-unsur lainnya karena struktur elektron pada kulit terluar (elektron valensi).
\(\ce{_2He: \:} \textcolor {red} {\ce {2}}\) → duplet
\(\ce{_10Ne: 2} \quad \textcolor {red} {\ce {8}}\) → oktet
\(\ce{_18Ar: 2 \quad 8} \quad \textcolor {red} {\ce {8}}\)
\(\ce{_36Kr: 2 \quad 8 \quad 18} \quad \textcolor {red} {\ce {8}}\)
\(\ce{_54Xe: 2 \quad 8 \quad 18 \quad 18} \quad \textcolor {red} {\ce {8}}\)
\(\ce{_86Rn: 2 \quad 8 \quad 18 \quad 32 \quad 18} \quad \textcolor {red} {\ce {8}}\)
Unsur-unsur lainnya dapat mencapai kondisi duplet atau oktet dengan cara melepas atau menerima elektron.
2. Ikatan Ion (Elektrovalen)
Suatu unsur dapat melepas elektron sehingga membentuk ion positif (kation). Elektron yang dilepas tersebut akan diterima oleh unsur lain yang membentuk ion negatif (anion). Kedua unsur tersebut akan membentuk ikatan yang disebut ikatan ion atau ikatan elektrovalen.
Unsur yang melepas elektron sehingga mencapai kondisi duplet atau oktet berada pada golongan IA, IIA dan IIIA (alumunium).
Sedangkan unsur yang menerima elektron sehingga berada pada kondisi oktet berada pada golongan VA, VIA dan VIIA.
Contoh:
Ikatan \(\ce{NaCl}\)
Ikatan antara unsur natrium dan klorin merupakan ikatan ion, dimana natrium akan melepas 1 elektron dan membentuk ion positif, sedangkan klorin akan menerima 1 elektron dan membentuk ion negatif.
Pembentukan ion \(\ce{Na^+}\) dan \(\ce{Cl^-}\)
\begin {array} {ll} & \ce{_{11} Na: 2 \quad 8} \quad {\textcolor {red} 1} \quad \quad \quad \ce{Na -> Na+ +} {\textcolor {red} e} \quad \quad \quad & \ce{Na+: 2 \quad 8} \\\\ & \ce{_{17} Cl: 2 \quad 8} \quad {\textcolor {blue} 7} \quad \quad \quad \ce{Cl +} {\textcolor {blue} e} \ce{-> Cl^-} \quad \quad \quad & \ce{Cl^-: 2 \quad 8} \quad {\textcolor {blue} 8} \end {array}
Satu elektron yang dilepas oleh atom Na akan diterima oleh atom Cl.
Reaksi antara atom Na dan Cl
\begin {array} {ll} & \ce{Na & -> Na+ +} {\textcolor {red} e} \\\\ & \ce{Cl +} {\textcolor {blue} e} & \ce{-> Cl^-} \quad \quad (+) \\ \hline \\ & \ce{Na + Cl & -> Na+ + Cl^-}\\\\ & \ce{Na + Cl & -> NaCl} \end {array}
Rumus Lewis NaCl
![]()
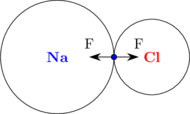
Perlu diperhatikan bahwa elektron yang dilepas oleh atom Na tidak sungguh-sungguh dilepaskan. Atom Na tidak kehilangan elektron tersebut, hanya elektron tersebut berada lebih dekat ke atom Cl. Elektron berada lebih dekat ke atom Cl karena unsur Cl memiliki keelektronegatifan lebih besar daripada unsur Na (Cl lebih negatif dan Na lebih positif).
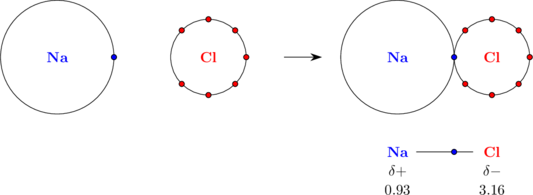
Elektron berada di antara atom Na dan atom Cl. Elektron tersebut mendapat gaya tarik dari inti atom Na dan inti atom Cl. Gaya tarik inti terhadap elektron ini yang membentuk ikatan antara atom Na dan atom Cl.
Letak elektron dalam orbital
\(\ce{^{}_{11}Na : [Ne] 3s^1}\)
![]()
\(\ce{^{}_{17}Cl : [Ne] 3s^2 3p^5}\)
![]()
Satu elektron \(\ce{Na}\) pada orbital \(\ce{3s}\) akan berpindah ke \(\ce{Cl}\) pada orbital \(\ce{3p^z}\) sehingga orbital pada ion \(\ce{Cl^-}\) menjadi:
![]()
3. Ikatan Ion Non Oktet
Beberapa unsur dapat membentuk ikatan ion walaupun tidak mencapai kondisi duplet/oktet. Misalnya:
\(\ce{Fe^{3+}: [Ar] 3d^5}\)
\(\ce{Cu^{2+}: [Ar] 3d^9}\)
\(\ce{Zn^{2+}: [Ar] 3d^{10}}\)
\(\ce{Ag^{+}: [Kr] 4d^{10}}\)
\(\ce{Pb^{2+}: [Xe] 4d^{14} 5d^{10} 6s^2}\)
4. Ciri-ciri Ikatan Ion
- Ikatan antara atom yang melepas elektron dan atom yang menerima elektron
- Ikatan antara atom logam dan nonlogam
- Kedua atom memiliki selisih nilai keelektronegatifan besar (umumnya memiliki selisih lebih dari 1,8)
- Memiliki ikatan yang sangat kuat
- Bersifat konduktor panas dan konduktor listrik dalam wujud padat dan cair
- Umumnya memiliki wujud padat pada suhu kamar (25°C), kecuali raksa memiliki wujud cair
B. IKATAN KOVALEN
Ikatan kovalen adalah ikatan yang terbentuk dari penggunaan bersama-sama pasangan elektron yang berasal dari kedua atom yang berikatan.
1. Ciri-ciri Ikatan Kovalen
- Ikatan antara atom-atom yang cenderung melepas elektron (golongan IVA, VA, VIA dan VIIA)
- Ikatan antara sesama atom nonlogam
- Kedua atom memiliki selisih nilai keelektronegatifan kecil
- Memiliki ikatan yang lemah
- Umumnya tidak dapat menghantarkan listrik, kecuali beberapa senyawa kovalen polar dalam bentuk larutan
2. Ikatan Kovalen (Duplet dan Oktet)
Ikatan kovalen yang mengikuti kaidah duplet atau oktet pada atom pusatnya.
Contohnya ikatan pada molekul \(\ce{H2}\)
Ikatan antara 2 atom hidrogen merupakan ikatan kovalen, dimana masing-masing atom hidrogen menyumbang 1 elektron untuk digunakan secara bersama-sama.
Konfigurasi atom H: \(\ce{_1 H: 1}\)
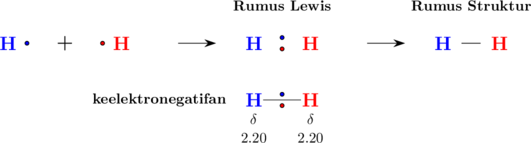
Terdapat 1 pasang elektron terikat antara 2 atom hidrogen dan mencapai kondisi stabil (duplet)
Elektron yang digunakan bersama terletak tepat di tengah di antara kedua atom hidrogen. Kondisi ini disebut ikatan kovalen nonpolar.
3. Ikatan Kovalen Non Oktet
Beberapa unsur yang tidak mengikuti kaidah oktet namun tetap dapat membentuk ikatan kovalen adalah Boron (B), Fosfor (P), Sulfur (S) dan Xenon (Xe).
Contohnya, ikatan pada molekul \(\ce{BF3}\)
Ikatan antara unsur boron dan fluorin merupakan ikatan kovalen, dimana 1 atom boron menyumbang 3 elektron dan 3 atom fluorin menyumbang masing-masing 1 elektron untuk digunakan secara bersama-sama.
Konfigurasi atom B
\(\ce{_5 B: 2 \quad 3}\)
Konfigurasi atom F
\(\ce{_{9} F: 2 \quad 7}\)
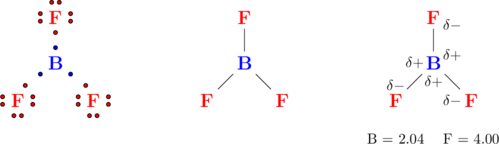
Atom B memiliki 3 elektron pada kulit terluarnya, dimana ketiganya dibagi untuk 3 atom F masing-masing 1 elektron. Sehingga pada atom B (atom pusat) memiliki 3 pasang elektron terikat.
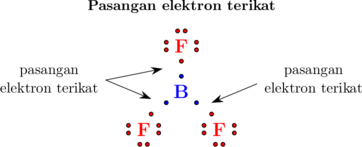
Di antara pasangan elektron terjadi gaya tolak menolak karena memiliki jenis muatan yang sama (elektron bermuatan negatif). Pada ikatan \(\ce{BF3}\), tiga pasang elektron terikat saling tolak menolak. Akibat gaya tolak menolak ini, pasangan elektron terikat saling menjauh satu sama lain. Sudut yang terbentuk di antara pasangan elektron terikat tersebut adalah 120°.
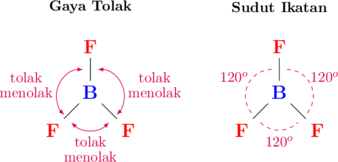
Ikatan antara B dan F adalah ikatan polar (memiliki nilai keelektronegatifan yang berbeda), namun molekul \(\ce{BF3}\) secara keseluruhan merupakan ikatan nonpolar. Hal ini dikarenakan geometri molekul \(\ce{BF3}\) simetris sehingga gaya tolak elektron saling menghilangkan.

4. Ikatan Kovalen Koordinat
Ikatan kovalen biasa adalah penggunaan bersama-sama pasangan elektron yang berasal dari kedua atom.
Ikatan kovalen koordinat adalah penggunaan bersama-sama pasangan elektron yang berasal dari salah satu atom saja.
Contohnya ikatan pada molekul \(\ce{SO2}\)
Konfigurasi atom S
\(\ce{_16 S: 2 \quad 8 \quad 6}\)
Konfigurasi atom O
\(\ce{_{8} O: 2 \quad 6}\)
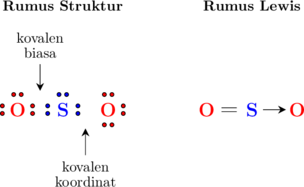
Atom O dengan 6 elektron valensi membutuhkan 2 elektron tambahan untuk mencapai kondisi oktet dan untuk itu menggunakan 2 elektron milik atom S.
Atom S dengan 6 elektron valensi juga membutuhkan 2 elektron tambahan, dan dapat menggunakan 2 elektron dari atom O (2 elektron tersebut berasal dari salah satu atom O).
Maka elektron yang digunakan bersama-sama hanya berasal dari salah satu atom O (bisa atom O di sebelah kiri atau sebelah kanan), dan pasangan elektron lainnya disebut kovalen koordinat.
Kovalen koordinat dilambangkan dengan tanda → mengarah kepada atom yang menggunakan elektron tersebut.
Ikatan pada atom pusat S terdiri atas 2 pasang elektron terikat dan 1 pasang elektron bebas. Pasangan elektron bebas memiliki gaya tolak yang lebih besar sehingga mendorong kedua pasangan elektron terikat sehingga membentuk sudut 119°.

Bentuk molekul seperti di atas menyebabkan molekul bersifat polar.
C. GEOMETRI MOLEKUL
| Jumlah Ikatan | Pasangan Elektron Terikat | Pasangan Elektron Bebas | Tipe Molekul | Geometri Molekul |
|---|---|---|---|---|
| 2 | 2 | 0 | \(\ce{AX2}\) |
Linear |
| 3 | 3 | 0 | \(\ce{AX3}\) |
Segitiga datar |
| 4 | 4 | 0 | \(\ce{AX4}\) |
Tetrahedral |
| 5 | 5 | 0 | \(\ce{AX5}\) |
Bipiramida segitiga |
| 6 | 6 | 0 | \(\ce{AX6}\) |
Oktahedral |
| 4 | 3 | 1 | \(\ce{AX3E}\) |
Oktahedral |
| 4 | 2 | 2 | \(\ce{AX2E2}\) |
Bentuk V |
| 5 | 4 | 1 | \(\ce{AX4E}\) |
Jungkat-jungkit (see-saw) |
| 5 | 3 | 2 | \(\ce{AX3E2}\) |
Bentuk T |
| 5 | 2 | 3 | \(\ce{AX2E3}\) |
Linear |
| 6 | 4 | 2 | \(\ce{AX4E2}\) |
Segiempat datar
|
| 7 | 6 | 1 | \(\ce{AX6E}\) |
Tetrahedral terdistorsi (menyimpang) |
D. HIBRIDISASI
1. Ikatan Sigma dan Ikatan Phi
Ikatan \(\sigma\) (sigma) adalah ikatan yang pertama terbentuk.
Ikatan \(\pi\) (phi) adalah ikatan yang terbentuk kedua atau ketiga (terjadi pada ikatan rangkap).

Ikatan tunggal selalu memiliki ikatan \(\sigma\)
Ikatan rangkap selalu memiliki ikatan \(\sigma\) dan ikatan \(\pi\)
2. Konsep Hibridisasi
Hibridisasi adalah penggabungan beberapa orbital sehingga orbital-orbital tersebut memiliki tingkat energi yang sama.
Sebagai contoh, lihat orbital 2s dan 2p
![]()
Orbital 2s dan 2p memiliki tingkat energi yang berbeda (menurut prinsip Aufbau, orbital 2s memiliki tingkat energi lebih rendah daripada orbital 2p)
Saat terjadi ikatan antar atom membentuk molekul, elektron-elektron yang digunakan bersama berada pada tingkat energi yang sama. Bagaimana ini terjadi sementara elektron-elektron tersebut berada pada orbital yang berbeda? Maka orbital-orbital tersebut akan mengalami "penyeragaman tingkat energi", yang disebut hibridisasi, dan digambarkan sebagai berikut:
![]()
Orbital 2s dan 2p mengalami hibridisasi dan memiliki tingkat energi yang sama.
Perlu diingat:
Ikatan \(\sigma\) mengalami hibridisasi
Ikatan \(\pi\) tidak mengalami hibridisasi
E. GAYA ANTAR MOLEKUL
Gaya antar molekul adalah gaya tarik-menarik di antara sesama molekul yang berdekatan. Gaya tarik-menarik tersebut menyebabkan molekul-molekul saling menyatu satu sama lain.
Gaya antar molekul dibedakan atas (dari paling lemah hingga paling kuat):
(A) Gaya Van Der Waals
(1) Dipol sesaat (gaya dispersi/gaya London)
(2) Dipol permanen
(B) Ikatan hidrogen
(C) Ikatan ion
(D) Jaringan molekul raksasa
Silika (SiO2), grafit (C) dan intan
Gaya antar molekul terkait erat dengan titik leleh dan titik didih molekul. Semakin besar gaya antar molekul, maka semakin besar juga titik leleh dan titik didih molekul tersebut. Hal ini dikarenakan dibutuhkan energi lebih yang melawan gaya antar molekul untuk memisahkan molekul-molekul tersebut.
1. Gaya Van der Waals: dipol sesaat
Interaksi dipol sesaat terjadi pada molekul-molekul dengan ikatan kovalen, misalnya gas hidrogen. Molekul gas hidrogen merupakan molekul nonpolar karena nilai keelektronegatifan yang sama, elektron-elektron berada tepat di tengah-tengah di antara kedua atom.
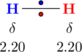
Saat elektron tepat berada di tengah-tengah, maka tidak ada polaritas pada molekul tersebut. Namun elektron bersifat "mobile", selalu bergerak dan berpindah tempat. Pada suatu waktu, elektron bisa berada lebih dekat ke salah satu atom, menyebabkan atom tersebut memiliki polaritas negatif dan atom yang lain memiliki polaritas positif.
![]()
Karena perbedaan polaritas pada molekul tersebut, molekul lain yang berada di dekatnya akan tertarik dengan polaritas yang berlawanan.
![]()
Perbedaan polaritas menyebabkan gaya tarik menarik antar molekul satu dengan molekul lainnya. Dan seterusnya terjadi pada semua molekul-molekul yang berdekatan.
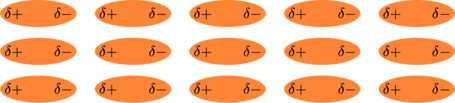
Karena elektron selalu berpindah tempat, maka polaritas antar molekul juga selalu berubah dan molekul-molekul melakukan penyesuaian (sinkronisasi).
Gaya dipol sesaat kadang disebut sebagai gaya dispersi, atau gaya London (dari nama penemunya Fritz London). Semua nama ini memiliki pengertian yang sama.
Dalam sistem periodik, semakin ke bawah (Mr semakin besar) gaya dipol sesaat juga semakin besar. Hal ini dikarenakan semakin ke bawah radius atom semakin besar dan jumlah elektron juga semakin banyak. Dengan demikian, peluang terjadinya dipol-dipol sesaat juga semakin sering terjadi.
Gaya dipol sesaat terjadi pada semua ikatan kovalen, baik molekul yang bersifat polar maupun nonpolar
2. Gaya Van der Waals: dipol permanen
Gaya dipol permanen secara khusus terjadi pada molekul-molekul yang bersifat polar. Contohnya molekul HCl.
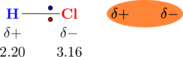
Perbedaan keelektronegatifan antara atom H dan atom Cl menyebabkan molekul memiliki polaritas yang berbeda. Perbedaan polaritas menyebabkan molekul-molekul lain di dekatnya akan terinduksi dan mengalami gaya tarik menarik.
Pada molekul kovalen polar, terdapat dua gaya antar molekul, yaitu gaya dipol sesaat (gaya London/gaya dispersi) dan gaya dipol permanen
Secara umum, gaya dipol sesaat lebih dominan (lebih besar) daripada gaya dipol permanen.
F. IKATAN HIDROGEN
Semakin besar massa molekul relatif (Mr) suatu molekul, semakin tinggi titik didih molekul tersebut, sejalan dengan gaya dispersi (gaya London) yang semakin besar. Hal ini disebabkan karena radius atom yang semakin besar dan jumlah elektron yang semakin banyak akan memperbesar kemungkinan terjadinya dipol-dipol terinduksi.
Titik didih Golongan IVA
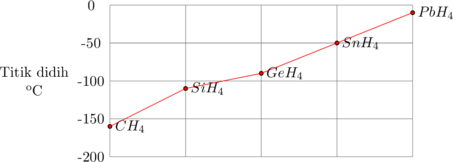
Titik didih Golongan VA. VIA dan VIIA
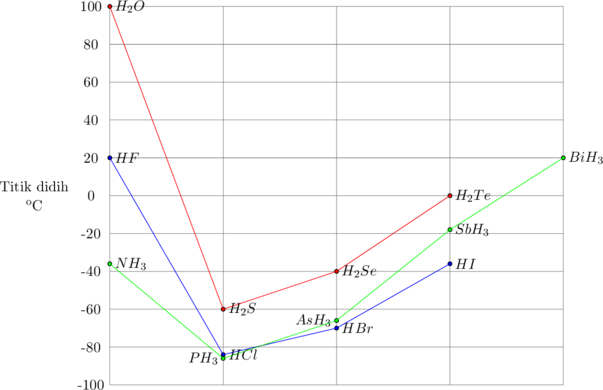
Pada golongan VA, VIA dan VIIA secara umum semakin ke bawah titik didih semakin meningkat sejalan dengan pertambahan Mr. Pengecualian terjadi pada senyawa NH3, H2O dan HF. Molekul-molekul NH3, H2O dan HF memiliki gaya antar molekul yang lebih besar, yang disebut ikatan hidrogen.
\(\ce{H2O}\)
Molekul H2O memiliki polaritas δ− pada atom O dan polaritas δ+ pada atom H. Molekul H2O juga memiliki 2 pasang elektron bebas. Bila 2 molekul H2O saling berdekatan, δ+ hidrogen pada salah satu molekul akan tertarik oleh pasangan elektron bebas dari molekul yang lain.
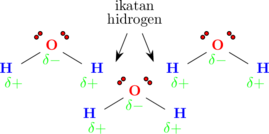
Molekul H2O memiliki 2 atom H dan 2 pasang elektron bebas, sehingga setiap molekul H2O dapat membentuk 2 ikatan hidrogen dengan 2 molekul H2O lainnya.
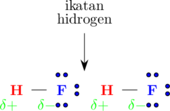
\(\ce{HF}\)
Demikian juga molekul HF yang memiliki 1 atom H dan 3 pasang elektron bebas, maka hanya 1 ikatan hidrogen yang terbentuk untuk setiap molekul HF.
\(\ce{NH3}\)
Molekul NH3 memiliki 3 atom H dan 1 pasang elektron bebas, sehingga hanya dapat membentuk 1 ikatan hidrogen untuk setiap molekul NH3.


![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1}A(-[:90]@{2}X)(-[:210]@{3}X)(-[:330]@{4}X)} \arclabel{0.5cm}{3}{1}{4}{\footnotesize \SI{120}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-bdcc12d5204b4c66186e1322056ee06c_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1}A(-[:90]@{2}X)(-[:199.5]@{3}X)(<[:300]@{4}X)(<:[:350]@{5}X)} \arclabel{0.5cm}{3}{1}{2}{\footnotesize \SI{109.5}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-37bf00b46dca594462f97fb0f3ba60b0_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1}A(-[:0]@{2}X)(-[:150]@{3}X)(-[:210]@{4}X)(-[:90]@{5}X)(-[:270]@{6}X)} \arclabel{0.5cm}{3}{1}{4}{\footnotesize \SI{120}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-bd3aae60f93d9443852bb8e711356419_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1}A(-[:30]@{2}X)(-[:150]@{3}X)(-[:210]@{4}X)(-[:330]@{5}X)(-[:90]@{6}X)(-[:270]@{7}X)} \arclabel{0.5cm}{3}{1}{4}{\footnotesize \SI{90}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-20fb9e2724b81bfb3ec6ceed30864f3a_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1}\charge{90=\:} {A}(-[:199.5]@{3}X)(<[:300]@{4}X)(<:[:350]@{5}X)} \arclabel{0.5cm}{3}{1}{4}{\footnotesize \SI{100}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-24853b8ad1cbf1186d6d598f52640c5b_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1}\charge{0=\:} {A}(-[:150]@{3}X)(-[:210]@{4}X)(-[:90]@{5}X)(-[:270]@{6}X)} \arclabel{0.5cm}{3}{1}{4}{\footnotesize \SI{120}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-210d1399a16884fee3b7b41719cec503_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1} \charge{135=\:,225=\:} {A}(-[2]@{2}X)(-[6]@{3}X)-@{4}X} \arclabel{0.5cm}{2}{1}{4}{\footnotesize \SI{90}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-5bbd0c6155d33324e36c1026aef8cd6e_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1} \charge{0=\:,135=\:,225=\:} {A}(-[2]@{2}X)(-[6]@{3}X)} \arclabel{0.5cm}{2}{1}{3}{\footnotesize \SI{180}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-5f886436079753174592d2df1760ea60_l3.png)
![Rendered by QuickLaTeX.com \begin{document} \chemfig{@{1} \charge{90=\:} {A}(-[:30]@{2}X)(-[:150]@{3}X)(-[:210]@{5}X)(-[:330]@{7}X)} \arclabel{0.5cm}{2}{1}{3}{\footnotesize \SI{90}{\degree}} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-63b79a9ea313266cc0de9229dd5d2570_l3.png)