A. TEORI ASAM BASA
1. Teori Asam-Basa Arrhenius
ASAM
zat yang melepas ion \(\ce{H+}\) dalam pelarut air
\(\ce{HCl (aq) -> H+ (aq) + Cl- (aq) }\)
\(\ce{H2S (g) -> 2H+ (aq) + S^{2-} (aq)}\)
BASA
zat yang melepas ion \(\ce{OH-}\) dalam pelarut air
\(\ce{NaOH (aq) -> Na+ (aq) + OH- (aq)}\)
\(\ce{Mg(OH)2 (aq) -> Mg^{2+} (aq) + 2OH- (aq)}\)
2. Teori Asam-Basa Bronsted-Lowry
ASAM
zat yang melepas 1 proton
(proton dilepas dalam bentuk ion \(\ce{H+}\))
BASA
zat yang menerima 1 proton
(proton diterima dalam bentuk ion \(\ce{H+}\))
Contoh:
\begin{equation*} \begin{array} & \ce{HF & + & NH3 & <=> & F- & + & NH4+ } \\\\ {\color{red}\text{Asam}} && {\color{red}\text{Basa}} && {\color{red}\text{Basa Konjugasi}} && {\color{red}\text{Asam Konjugasi}} \end{array} \end{equation*}
\begin{equation*} \begin{array} & \ce{H2SO4 & + & CO3^{2-} & <=> & HSO4^{-} & + & HCO3- } \\\\ {\color{red}\text{Asam}} && {\color{red}\text{Basa}} && {\color{red}\text{Basa Konjugasi}} && {\color{red}\text{Asam Konjugasi}} \end{array} \end{equation*}
3. Teori Asam-Basa Lewis
Teori asam-basa Lewis menyatakan bahwa:
- Asam adalah zat yang menerima pasangan elektron (akseptor)
- Basa adalah zat yang memberikan pasangan elektron (donor)
Pada reaksi:
\(\ce{NH3 (g) + HCl (aq) -> NH4Cl(aq)}\)

Pasangan elektron bebas yang dimiliki atom \(\ce{N}\) diberikan pada atom \(\ce{H}\)
\(\ce{NH3}\) sebagai donor elektron adalah basa
\(\ce{HCl}\) sebagai akseptor elektron adalah asam
4. Zat Amfoter
Zat amfoter adalah zat yang dapat bertindak sebagai asam dan basa.
\begin{equation*} \begin{array} & \ce{NH3 & + & NH3 & <=> &NH4+ & + & NH2- } \\\\ {\color{red}\text{Asam}} && {\color{red}\text{Basa}} && {\color{red}\text{Asam Konjugasi}} && {\color{red}\text{Basa Konjugasi}} \end{array} \end{equation*}
\begin{equation*} \begin{array} & \ce{H2O & + & H2O & <=> & H3O+ & + & OH- } \\\\ {\color{red}\text{Asam}} && {\color{red}\text{Basa}} && {\color{red}\text{Asam Konjugasi}} && {\color{red}\text{Basa Konjugasi}} \end{array} \end{equation*}
B. pH LARUTAN
Tingkat keasaman/kebasaan suatu larutan ditentukan oleh besarnya konsentrasi ion \(\ce{H+}\) atau \(\ce{OH-}\) dari larutan tersebut.
pH dan pOH adalah skala yang digunakan untuk mempermudah penulisannya (seringkali konsentrasi ion dalam bentuk pangkat negatif yang besar).
\(\bbox[10px, border: 2px solid red]{\ce{pH = - \log [H+]}}\)
\(\ce{[H+]}\) = konsentrasi ion \(\ce{H+}\)
\(\bbox[10px, border: 2px solid red]{\ce{pOH = - \log [OH-]}}\)
\(\ce{[OH-]}\) = konsentrasi ion \(\ce{OH-}\)
\(\bbox[10px, border: 2px solid red]{\ce{ [H+] \:.\: [OH-] = Kw}}\)
\(\ce{ [H+] \:.\: [OH-] = 10^{-14}}\)
\(\bbox[10px, border: 2px solid red]{\ce{pH + pOH} = \text{pKw}}\)
\(\ce{pH + pOH} = 14\)

1. pH Larutan Asam
Karena zat asam menambah ion \(\ce{H+}\) pada larutan, maka pH larutan asam dihitung dari konsentrasi ion \(\ce{H+}\).
Asam kuat
\(\bbox[10px, border: 2px solid red]{\ce{[H+]} = \text{a} \:.\: \text{M}}\)
\(\text{a}\) = jumlah ion \(\ce{H+}\)
\(\text{M}\) = konsentrasi larutan
Yang termasuk asam kuat adalah
\(\ce{HCl, HBr, HI, HClO3, HClO4, HNO3, H2SO4}\)
Larutan asam kuat mengalami ionisasi 100%
Asam lemah
\(\bbox[10px, border: 2px solid red]{\ce{[H+]} = \sqrt{\text{Ka} \:.\: \text{M}}}\)
\(\bbox[10px, border: 2px solid red]{\ce{[H+]} = \alpha \:.\: \text{M}}\)
\(\text{Ka}\) = tetapan kesetimbangan asam
\(\alpha\) = derajat ionisasi larutan
Yang termasuk asam lemah adalah semua asam lain yang tidak tergolong asam kuat
Larutan asam lemah mengalami ionisasi sebagian
2. pH Larutan Basa
Karena zat basa menambah ion \(\ce{OH-}\) pada larutan, maka pH larutan basa dihitung dari konsentrasi ion \(\ce{OH-}\).
Basa kuat
\(\bbox[10px, border: 2px solid red]{\ce{[OH-]} = \text{b} \:.\: \text{M}}\)
\(\text{b}\) = jumlah ion \(\ce{OH-}\)
\(\text{M}\) = konsentrasi larutan
Yang termasuk basa kuat adalah
Golongan IA: \(\ce{LiOH, NaOH, KOH, RbOH, CsOH}\)
Golongan IIA: \(\ce{Ca(OH)2, Sr(OH)2, Ba(OH)2}\)
Larutan basa kuat mengalami ionisasi 100%
Basa lemah
\(\bbox[10px, border: 2px solid red]{\ce{[OH-]} = \sqrt{\text{Kb} \:.\: \text{M}}}\)
\(\bbox[10px, border: 2px solid red]{\ce{[OH-]} = \alpha \:.\: \text{M}}\)
\(\text{Kb}\) = tetapan kesetimbangan basa
\(\alpha\) = derajat ionisasi larutan
\(\text{M}\) = konsentrasi larutan
Yang termasuk basa lemah adalah semua basa lain yang tidak tergolong basa kuat
Larutan basa lemah mengalami ionisasi sebagian
Tetapan Kesetimbangan Asam (Ka)
Misalkan HA adalah asam lemah. Di dalam air, reaksi yang terjadi adalah reaksi kesetimbangan:
\(\ce{HA (aq) + H2O(l) <=> H3O+ (aq) + A- (aq)}\)
Tetapan kesetimbangan:
\begin{equation*} \begin{split} \text{Kc} & = \dfrac {[\ce{H3O+}] \:.\: [\ce{A-}]}{[\ce{HA}] \:.\: [\ce{H2O}]} \\\\ \text{Kc} \:.\: [\ce{H2O}] & = \dfrac {[\ce{H3O+}] \:.\: [\ce{A-}]}{[\ce{HA}]} \\\\ \text{Ka} & = \dfrac {[\ce{H3O+}] \:.\: [\ce{A-}]}{[\ce{HA}]} \\\\ \text{Ka} & = \dfrac {[\ce{H+}] \:.\: [\ce{A-}]}{[\ce{HA}]} \end{split} \end{equation*}
Keterangan:
- \(\text{Ka} = \text{Kc} \:.\: [\ce{H2O}] \)
- Konsentrasi \(\ce{H2O}\) relatif konstan/tidak berubah banyak.
- \(\ce{[H3O+] = [H+]}\)
Tetapan Kesetimbangan Basa (Kb)
Misalkan LOH adalah basa lemah. Di dalam air, reaksi yang terjadi adalah reaksi kesetimbangan:
\(\ce{LOH (aq) <=> L+ (aq) + OH- (aq)}\)
Tetapan kesetimbangan:
\begin{equation*} \begin{split} \text{Kb} & = \dfrac {[\ce{L+}] \:.\: [\ce{OH-}]}{[\ce{LOH}] } \end{split} \end{equation*}
C. TITRASI ASAM BASA
Indikator pH
Indikator pH adalah suatu zat yang ditambahkan ke dalam larutan dalam jumlah yang cukup kecil. Penambahan indikator ke dalam larutan akan mengubah warna larutan tersebut. Warna yang muncul dalam larutan dapat memberikan informasi mengenai nilai pH larutan.
Beberapa jenis indikator disajikan dalam tabel berikut:
| Nama Indikator | Rentang pH | Rentang Warna |
|---|---|---|
| Metil kuning | 2,9 − 4,0 | Merah − Kuning |
| Bromfenol biru | 3,0 − 4,6 | Kuning − Biru |
| Kertas litmus | 4,5 − 8,3 | Merah − Biru |
| Bromtimol biru | 6,0 − 7,6 | Kuning − Biru |
| Fenolftalein | 8,3 − 10 | Tak berwarna − Pink |
Indikator Universal
Indikator universal merupakan gabungan dari beberapa indikator. Indikator universal memiliki rentang pH yang lebar.
Rentang pH dan warna dari indikator universal disajikan dalam tabel berikut:
| Rentang pH | Warna |
|---|---|
| < 3 | Merah |
| 3 − 6 | Orange atau kuning |
| 7 | Hijau |
| 8 − 11 | Biru |
| > 11 | Ungu |
Titrasi Asam Basa
Titrasi asam basa adalah prosedur yang dilakukan untuk menentukan kosentrasi (molaritas) suatu asam atau basa berdasarkan reaksi netralisasi.
1. Reaksi netralisasi
Reaksi netralisasi adalah reaksi antara asam dan basa dimana keduanya habis bereaksi. Jumlah mol ion \(\ce{H+}\) sama dengan jumlah mol ion \(\ce{OH-}\).
\(\bbox[10px, border: 2px solid red]{\text{mol} \: \ce{H+} = \text{mol} \: \ce{OH-}}\)
\(a \:.\: \text{V}_{\text{Asam}} \:.\: \text{M}_{\text{Asam}} = b \:.\: \text{V}_{\text{Basa}} \:.\: \text{M}_{\text{Basa}}\)
\(a\) adalah jumlah ion \(\ce{H+}\) pada molekul asam
\(b\) adalah jumlah ion \(\ce{OH-}\) pada molekul basa
2. Kurva titrasi
Basa kuat dititrasi oleh asam kuat
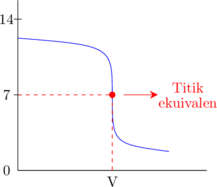
Asam kuat dititrasi oleh basa kuat
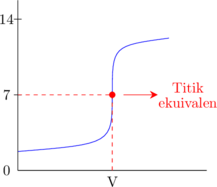
Basa lemah dititrasi oleh asam kuat
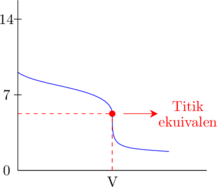
Asam kuat dititrasi oleh basa lemah
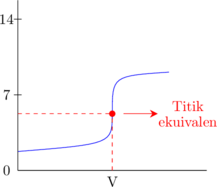
Basa kuat dititrasi oleh asam lemah
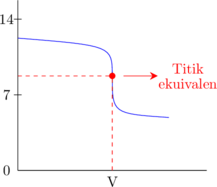
Asam lemah dititrasi oleh basa kuat
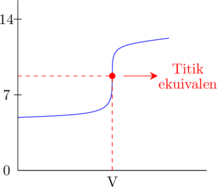
Basa lemah dititrasi oleh asam lemah
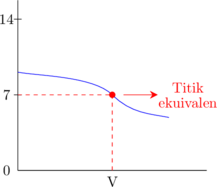
Asam lemah dititrasi oleh basa lemah
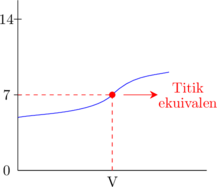
3. Pemilihan indikator yang sesuai
Indikator yang sesuai apabila perubahan warna terjadi pada daerah perubahan pH yang drastis.
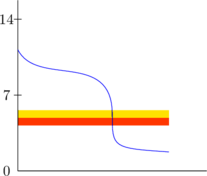
Indikator di samping sudah sesuai karena perubahan warna terjadi pada perubahan pH yang drastis.
Titik equivalen terjadi saat warna orange pertama kali muncul.
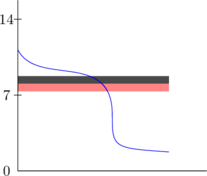
Indikator di samping tidak sesuai karena perubahan warna terjadi sebelum terjadi perubahan pH yang drastis.
A. Teori Asam Basa B. PH Larutan C. Titrasi D. Persiapan Ulangan Kembali ke Modul SMA
