A. ATOM DAN MOLEKUL
Atom merupakan partikel terkecil yang tidak dapat dipisahkan dengan cara kimia biasa.
![]()
Atom
Molekul merupakan gabungan dari beberapa atom. Ada 2 macam molekul, yaitu molekul unsur dan molekul senyawa. Molekul unsur adalah molekul yang terdiri atas 1 jenis unsur saja, sedangkan molekul senyawa terdiri atas 2 atau lebih unsur berbeda.
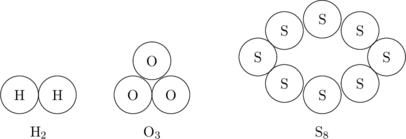
Molekul unsur
Molekul yang terdiri dari satu jenis unsur saja
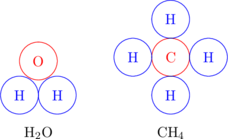
Molekul senyawa
Molekul yang terdiri dari 2 atau lebih unsur berbeda
Contoh:
Tentukan jumlah atom masing-masing unsur dalam 3 molekul \(\ce{H2O}\).
3 molekul \(\ce{H2O}\) dapat ditulis sebagai \(\ce{3 H2O}\)
Banyaknya atom \(\ce{H}\) = \(3 \times 2 = 6\) atom \(\ce{H}\)
Banyaknya atom \(\ce{O}\) = \(3 \times 1 = 3\) atom \(\ce{O}\)
B. KONSEP MOL
Mol dan jumlah partikel
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{N}}{\text{N}_{\text{A}}}}\)
N = jumlah partikel (atom atau molekul)
NA = bilangan Avogadro \(6,02 \times 10^{23}\)
Mol dan massa zat
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{m}}{\text{Ar}}}\) atau \(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{m}}{\text{Mr}}}\)
m = massa zat
Ar = massa atom relatif
Mr = massa molekul relatif
Mol dan volume gas pada kondisi STP 0ºC dan 1 atm
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{V}}{22,4}}\)
(Khusus gas)
Mol dan volume gas pada kondisi RTP 25ºC dan 1 atm
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{V}}{24,4}}\)
(Khusus gas)
Mol dan Konsentrasi
\(\bbox[5px, border: 2px solid red] {\text{n} = \text{V} \:.\: \text{M}}\)
M = konsentrasi (molaritas)
Konsentrasi Molar
\(\bbox[5px, border: 2px solid red] {\text{M} = \dfrac {\rho \:.\: \% \:.\: 10}{\text{Mr}}}\)
ρ = massa jenis (gr/mL)
% = persentase massa
C. PERSAMAAN GAS IDEAL
\(\bbox[5px, border: 2px solid red] {\text{P} \:.\: \text{V} = \text{n} \:.\: \text{R} \:.\: \text{T}}\)
P = tekanan gas (dalam satuan atm)
1 atm = 76 cmHg
V = volume gas (dalam satuan liter)
1 liter = 1 dm³
T = suhu gas (dalam satuan Kelvin)
Kelvin = Celcius + 273
n = jumlah mol gas
R = konstanta = 0,082
D. RUMUS EMPIRIS DAN RUMUS SENYAWA
Rumus molekul atau rumus senyawa adalah cara penulisan dari suatu molekul atau senyawa.
Misalnya \(\ce{C4H10, C6H6, NH3}\) dan lain-lain.
Rumus empiris adalah bentuk yang disederhanakan dari rumus molekul. Misalnya rumus molekul \(\ce{C4H10}\) memiliki rumus empiris \(\ce{C2H5}\). Kadang rumus empiris suatu senyawa sama dengan rumus molekulnya, karena sudah tidak bisa disederhanakan lagi. Misalnya rumus molekul \(\ce{NH3}\) memiliki rumus empiris \(\ce{NH3}\) juga.
Rumus empiris suatu senyawa pada dasarnya merupakan perbandingan mol antara atom-atomnya. Misalnya pada rumus empiris \(\ce{C2H5}\), maka mol C : mol H = 2 : 5.
Rumus struktur adalah gambar yang menunjukkan ikatan antar atom dalam suatu molekul. Sebagai contoh, rumus struktur asam asetat memiliki rumus struktur seperti di bawah ini:
![Rendered by QuickLaTeX.com \begin{document} \chemname {\chemfig{H-C(-[2]H)(-[6]H)-C(=[2]O)- O - H}} {Asam asetat} \end{document}](https://clavius.id/wp-content/ql-cache/quicklatex.com-a2959aab9082f9c572c61719cd17a9f7_l3.png)
Dari rumus struktur di atas, rumus molekul asam asetat adalah \(\ce{CH3COOH}\) atau \(\ce{C2H4O2}\) dan rumus empirisnya adalah \(\ce{CH2O}\).
