A. PERSAMAAN GAS IDEAL
Karakteristik Gas Ideal
- Gas terdiri dari molekul yang jumlahnya sangat banyak
- Ukuran molekul gas sangat kecil dan jarak antar molekul sangat besar
- Molekul bergerak lurus dan memenuhi hukum Newton
- Tumbukan yang terjadi lenting sempurna
- Gaya antar molekul diabaikan
- Molekul dalam wadah sejenis/identik
Persamaan Gas Ideal
Dalam sebuah ruang tertutup, gas ideal memenuhi persamaan:
\(\bbox[10px, border: 2px solid red]{P \:.\: V = n \:.\: R \:.\: T}\)
\(P\) = tekanan (atm)
\(V\) = volume (liter)
\(n\) = mol (mol)
\(R = 0,082\)
\(T\) = suhu (K)
\(\bbox[10px, border: 2px solid red]{P \:.\: V = n \:.\: R \:.\: T}\)
\(P\) = tekanan (Pa)
\(V\) = volume (m³)
\(n\) = mol (mol)
\(R = 8,314\)
\(T\) = suhu (K)
\(\bbox[10px, border: 2px solid red]{P \:.\: V = N \:.\: k \:.\: T}\)
\(P\) = tekanan (Pa)
\(V\) = volume (m³)
\(N\) = jumlah molekul
\(k = 1,38 × 10^{−23}\)
\(T\) = suhu (K)
B. ENERGI KINETIK GAS
Energi kinetik gas ideal dapat ditentukan sebagai berikut:
Energi kinetik atom tunggal
\(E_k = f \:.\: \dfrac 12 \:.\: k \:.\: T\)
\(f\) = derajat kebebasan
\(k = 1,38 \times 10^{-23}\)
\(T\) = suhu (K)
Energi kinetik total
\(E_k = f \:.\: \dfrac 12 \:.\: N \:.\: k \:.\: T\)
\(f\) = derajat kebebasan
\(N\) = jumlah atom/molekul
\(k = 1,38 \times 10^{-23}\)
\(T\) = suhu (K)
Energi kinetik total
\(E_k = f \:.\: \dfrac 12 \:.\: n \:.\: R \:.\: T\)
\(f\) = derajat kebebasan
\(n\) = jumlah mol
\(R = 8,314\)
\(T\) = suhu (K)
DERAJAT KEBEBASAN (f)
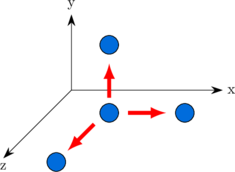
Derajat kebebasan translasi
Sebuah atom/molekul dapat bergerak dalam 3 arah translasi, arah X, Y dan Z. Maka atom/molekul memiliki 3 derajat kebebasan translasi.
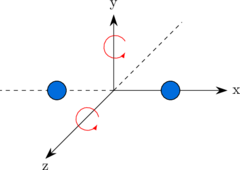
Derajat kebebasan rotasi
Sebuah molekul dapat berotasi. Untuk molekul diatomik, memiliki dua arah rotasi, sedangkan untuk molekul poliatomik non linear memiliki 3 arah rotasi. Atom tunggal tidak memiliki derajat kebebasan rotasi.
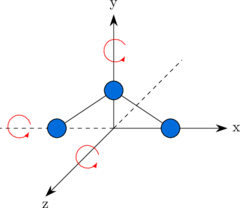
Derajat kebebasan vibrasi
Sebuah molekul dapat bervibrasi dengan mengubah jarak antar atom.
![]()
DERAJAT KEBEBASAN GAS MONOATOMIK
| Suhu | Translasi | Rotasi | Vibrasi |
|---|---|---|---|
| Suhu normal | 3 | − | − |
| Suhu tinggi (> 1.000 K) | 3 | − | − |
DERAJAT KEBEBASAN MOLEKUL LINEAR
| Suhu | Translasi | Rotasi | Vibrasi |
|---|---|---|---|
| Suhu normal | 3 | 2 | − |
| Suhu tinggi (> 1.000 K) | 3 | 2 | 3N − 5 |
DERAJAT KEBEBASAN GAS MOLEKUL NON LINEAR
| Suhu | Translasi | Rotasi | Vibrasi |
|---|---|---|---|
| Suhu normal | 3 | 3 | − |
| Suhu tinggi (> 1.000 K) | 3 | 3 | 3N − 6 |
C. KELAJUAN EFEKTIF
A. Kelajuan Rata-rata (\(\bar v \))
Kelajuan rata-rata gas ideal yang terdiri dari N atom/molekul didefinisikan sebagai:
\(\bbox[10px, border: 2px solid red]{ \bar v = \dfrac {v_1 + v_2 + v_3 + \dotso}{N}}\)
B. Kelajuan Efektif (vrms)
Kelajuan efektif gas ideal yang terdiri dari N atom/molekul didefinisikan sebagai:
\(\bbox[10px, border: 2px solid red]{v_{\text{rms}} = \sqrt {\dfrac {v_1^2 + v_2^2 + v_3^2 + \dotso}{N}}}\)
Nilai kelajuan efektif partikel (atom/molekul) tergantung dari suhu gas tersebut.
Kelajuan Efektif Gas
\(v = \sqrt{\dfrac {3 \:.\: R \:.\: T}{M}}\)
\(R = 8,314\)
\(T\) = suhu (K)
\(M\) = massa molekul relatif
Kelajuan Efektif Gas
\(v = \sqrt{\dfrac {3 \:.\: k \:.\: T}{m}}\)
\(k = 1,38 × 10^{−23}\)
\(T\) = suhu (K)
\(m\) = massa 1 atom/molekul (kg)
Kelajuan Efektif Gas
\(v = \sqrt{\dfrac {3 \:.\: P}{\rho}}\)
\(P\) = tekanan (Pa)
\(\rho\) = massa jenis gas (kg/m³)
