Radius Atom
Radius atom adalah jarak dari inti atom ke elektron terluar.
Faktor yang mempengaruhi radius atom adalah:
-
- gaya tarik menarik (gaya elektrostatik) antara muatan positif (proton) pada inti atom dan muatan negatif (elektron)
- jumlah lintasan (kulit) elektron
Dalam satu periode
Semakin ke arah kanan, radius atom akan semakin kecil. Hal ini disebabkan semakin ke arah kanan, nomor atom unsur semakin besar. Karenanya, jumlah muatan positif (proton) akan semakin banyak. Sehingga akan menyebabkan gaya tarik menarik (gaya elektrostatik) antara muatan positif (proton dalam inti) dan muatan negatif (elektron pada lintasan terluar) semakin besar. Gaya tarik tersebut akan membuat elektron semakin mendekat ke arah inti yang menyebabkan radius atom mengecil.
Dalam satu golongan
Semakin ke arah bawah, radius atom akan semakin besar. Hal ini disebabkan semakin ke arah bawah, lintasan (kulit) elektron semakin banyak sehingga elektron pada kulit terluar semakin jauh dari inti.

Sumber: Wikipedia
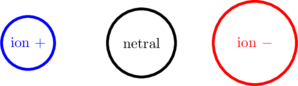
Radius Ion
Radius ion positif (kation)
Radius ion positif (kation) lebih kecil daripada atom netralnya. Ion positif merupakan atom netral yang melepas elektron pada kulit terluarnya. Berkurangnya elektron pada kulit terluar menyebabkan dua hal:
∗ radius lintasan elektron pada kulit terluar akan lebih kecil karena jumlah elektron yang lebih sedikit
∗ gaya tarik proton dalam inti terhadap elektron akan semakin besar karena jumlah proton lebih banyak daripada jumlah elektronnya, yang akhirnya juga akan menyebabkan radius mengecil
Radius ion negatif (anion)
Radius ion negatif (anion) lebih besar daripada atom netralnya. Ion negatif merupakan atom netral yang menerima elektron pada kulit terluarnya. Bertambahnya elektron pada kulit terluar menyebabkan dua hal:
∗ radius lintasan elektron pada kulit terluar akan lebih besar karena jumlah elektron yang lebih banyak
∗ gaya tarik proton dalam inti terhadap elektron akan semakin kecil karena jumlah proton lebih sedikit daripada jumlah elektronnya, yang akhirnya juga akan menyebabkan radius membesar
ENERGI IONISASI
Energi ionisasi adalah energi yang dibutuhkan 1 mol atom dalam wujud gas untuk melepas satu elektron pada kulit terluarnya sehingga membentuk ion positif dalam wujud gas.
\(\ce{X_{(g)} -> X^{+}_{(g)} + e}\)
Dalam satu periode
Semakin ke arah kanan, energi ionisasi akan semakin besar. Hal ini disebabkan semakin ke arah kanan, radius atom semakin kecil dan gaya tarik inti terhadap elektron semakin besar. Sehingga semakin besar energi yang dibutuhkan untuk melepaskan elektron dari atom.
Dalam satu golongan
Semakin ke arah bawah, energi ionisasi akan semakin kecil. Hal ini disebabkan semakin ke arah bawah, radius atom semakin besar dan gaya tarik inti terhadap elektron semakin kecil. Sehingga semakin kecil energi yang dibutuhkan untuk melepaskan elektron dari atom.

Pengecualian pada golongan IIIA
Dalam satu periode, kecenderungan energi ionisasi ke arah kanan semakin besar. Namun pengecualian terjadi pada golongan IIIA dimana energi ionisasi unsur golongan IIIA lebih kecil daripada golongan IIA. Sebagai contoh, bandingkan antara atom Be (golongan IIA) dan B (golongan IIIA):
\(\ce{^{}_{4}B : 1s^2 2s^2} \quad \text{EI = 900 kJ/mol}\)
\(\ce{^{}_{5}Be : 1s^2 2s^2 2p_x^1} \quad \text{EI = 799 kJ/mol}\)
Elektron yang dilepas oleh atom B berada pada orbital \(2s^2\) sedangkan elektron yang dilepas oleh atom Be berada pada orbital \(2p_x^1\). Orbital \(2p\) memiliki tingkat energi yang lebih tinggi daripada orbital \(2s\) (prinsip aufbau). Tingkat energi yang lebih tinggi berarti jarak yang lebih jauh dari inti. Dengan kata lain, elektron pada orbital \(2p_x^1\) lebih jauh dari inti daripada elektron pada orbital \(2s^2\). Dengan jarak yang lebih jauh, akan menyebabkan gaya tarik inti lebih kecil, sehingga dibutuhkan energi lebih rendah.
Pengecualian pada golongan VIA
Pengecualian golongan VIA memiliki energi ionisasi lebih rendah daripada golongan VA dapat dijelaskan sebagai berikut:
\(\ce{^{}_{7}N : 1s^2 2s^2 2p_x^1 2p_y^1 2p_z^1} \quad \text{EI = 1400 kJ/mol}\)
\(\ce{^{}_{8}O : 1s^2 2s^2 2p_x^2 2p_y^1 2p_z^1} \quad \text{EI = 1310 kJ/mol}\)
Elektron yang dilepas oleh atom N dan atom O berada pada orbital yang sama, yaitu orbital p. Pada atom O, satu elektron dilepaskan dari orbital \(2p_x^2\) yang merupakan pasangan elektron dalam orbital yang sama. Elektron yang berpasangan dalam satu orbital memiliki gaya tolak menolak antar elektron (gaya elektrostatik muatan sejenis) sehingga dengan adanya gaya tolak menolak antar elektron tersebut, sedikit lebih mudah untuk melepas satu elektron pada orbital \(2p_x^2\).
Energi ionisasi tingkat 1, 2, 3, dst
Saat atom netral melepas satu elektron dan menjadi ion positif (+1), energi yang dibutuhkan disebut energi ionisasi tingkat satu. Saat ion positif (+1) melepas satu elektron lagi dan menjadi ion positif (+2), energi yang dibutuhkan disebut energi ionisasi tingkat dua. Dan seterusnya.
Energi ionisasi tingkat satu: \(\ce{X_{(g)} -> X^{+}_{(g)} + e} \quad \text{EI}_1\)
Energi ionisasi tingkat dua: \(\ce{X^+_{(g)} -> X^{2+}_{(g)} + e} \quad \text{EI}_2\)
Energi ionisasi tingkat tiga: \(\ce{X^{2+}_{(g)} -> X^{3+}_{(g)} + e} \quad \text{EI}_3\)
Dan seterusnya.
\(\text{EI}_1 < \text{EI}_2 < \text{EI}_3 < \dotso\)
Kenaikan energi ionisasi tingkat 2, 3, ... disebabkan karena perbedaan tingkat energi dari elektron yang akan dilepaskan. Sebagai contoh atom Al.
Energi ionisasi ke satu: \(\ce{Al_{(g)} -> Al^{+}_{(g)} + e} \quad \text{EI = 577 kJ/mol}\)
Energi ionisasi ke dua: \(\ce{Al^+_{(g)} -> Al^{2+}_{(g)} + e} \quad \text{EI = 1820 kJ/mol}\)
Energi ionisasi ke tiga: \(\ce{Al^{2+}_{(g)} -> Al^{3+}_{(g)} + e} \quad \text{EI = 2740 kJ/mol}\)
Energi ionisasi ke empat: \(\ce{Al^{2+}_{(g)} -> Al^{3+}_{(g)} + e} \quad \text{EI = 11600 kJ/mol}\)
Konfigurasi elektron Al adalah \(\ce{^{}_{13}Al : 1s^2 2s^2 2p^6 3s^2 3p^1}\)
Energi ionisasi tingkat 1 dibutuhkan untuk melepas satu elektron pada orbital \(3p^1\) yang merupakan orbital dengan tingkat energi paling tinggi (paling jauh dari inti).
Setelah melepas satu elektron, konfigurasi menjadi \(\ce{^{}_{13}Al^{+} : 1s^2 2s^2 2p^6 3s^2}\)
Setelah Energi ionisasi tingkat 2 dibutuhkan untuk melepas satu elektron dari orbital \(3s^2\). Orbital \(3s^2\) memiliki tingkat energi lebih rendah daripada orbital \(3p^1\) yang berarti orbital \(3s^2\) lebih dekat ke inti, sehingga dibutuhkan energi lebih besar untuk melepas elektron. Alasan lainnya, sekarang jumlah muatan positif (proton) lebih banyak daripada jumlah muatan negatif (elektron) sehingga gaya tarik menjadi lebih besar, yang membuat semakin sulit untuk melepas elektron.
Kenaikan besar terjadi pada energi ionisasi ke 4 karena elektron yang dilepas terletak pada orbital \(2p\), dimana elektron berada pada lintasan 2. Tiga elektron yang dilepas sebelumnya terletak pada orbital \(3s\) dan \(3p\) dimana elektron berada pada lintasan 3. Radius elektron pada lintasan 2 jauh lebih kecil daripada radius elektron pada lintasan 3 sehingga gaya tarik inti jauh lebih besar.
Perbedaan besar ini dapat dijadikan acuan untuk menentukan elektron valensi suatu unsur (golongan unsur). Pada contoh di atas, elektron valensi Al adalah 3, sehingga dapat disimpulkan bahwa Al berada pada golongan IIIA.

Energi Ionisasi dan Kereaktifan Logam
Energi ionisasi yang besar akan menyebabkan unsur logam sulit untuk bereaksi karena dibutuhkan energi yang besar untuk melepas elektron.
Semakin besar energi ionisasi, semakin kurang reaktif suatu unsur logam. Semakin kecil energi ionisasi, unsur logam akan semakin reaktif.
AFINITAS ELEKTRON
Afinitas elektron adalah energi yang dilepaskan saat atom dalam wujud gas menerima 1 elektron sehingga membentuk ion negatif (−1) dalam wujud gas.
\(\ce{X_{(g)} + e -> X^{-}_{(g)}}\)
Dalam satu periode
Semakin ke arah kanan, afinitas elektron akan semakin besar. Hal ini disebabkan semakin ke arah kanan, radius atom semakin kecil dan gaya tarik inti terhadap elektron semakin besar. Karena gaya tarik inti semakin besar, maka semakin mudah untuk menarik elektron dari luar, sehingga energi yang dilepaskan semakin besar.
Dalam satu golongan
Semakin ke arah bawah, afinitas elektron akan semakin kecil. Hal ini disebabkan semakin ke arah bawah, radius atom semakin besar dan gaya tarik inti terhadap elektron semakin kecil. Karena gaya tarik inti semakin kecil, maka semakin sulit untuk menarik elektron dari luar, sehingga energi yang dilepaskan semakin kecil.
Pengecualian pada Oksigen dan Fluorin
Dalam 1 golongan, kecenderungan afinitas elektron semakin ke arah bawah semakin kecil. Namun pengecualian terjadi pada atom oksigen dan atom fluorin.
Fluorin terletak pada periode 2 dengan radius atom yang kecil, sehingga ukuran atom fluorin sangat kecil. Fluorin juga terletak pada golongan VIIA, yang berarti memiliki 7 elektron valensi. Dengan ukuran yang sangat kecil namun dipenuhi elektron, menyebabkan jarak antar elektron berdekatan sehingga gaya tolak menolak antar elektron besar. Penambahan 1 elektron dari luar akan membuat gaya tolak tersebut semakin besar. Gaya tolak antar elektron tersebut mengurangi gaya tarik dari inti.
Hal yang sama juga terjadi pada atom oksigen.
Afinitas elektron, tingkat 1, 2, dst
\(\ce{X_{(g)} + e -> X^{-}_{(g)}} \quad (-)\)
\(\ce{X^-_{(g)} + e -> X^{2-}_{(g)}} \quad (+)\)
Tanda (−) menunjukkan energi dilepaskan saat reaksi terjadi, sedangkan tanda (+) menunjukkan energi dibutuhkan saat reaksi terjadi.
Afinitas elektron tingkat 2 hanya berlaku untuk unsur pada periode VIA, dimana unsur-unsur pada periode VIA membutuhkan 2 elektron untuk memenuhi kaidah oktet.
AFINITAS ELEKTRON DAN KEREAKTIFAN UNSUR NON LOGAM
Afinitas elektron yang besar (semakin besar energi yang dilepaskan) akan membuat unsur non logam lebih reaktif. Sedangkan affinitas yang kecil akan membuat unsur non logam semakin tidak reaktif.
KEELEKTRONEGATIFAN
Keelektronegatifan adalah kecenderungan sebuah atom untuk menarik pasangan elektron dalam suatu ikatan.
Jika atom A dan B saling berikatan dan berbagi satu pasang elektron. Keelektronegatifan atom A dan B akan menentukan posisi pasangan elektron tersebut.
A dan B memiliki keelektronegatifan yang sama
![]()
Karena A dan B memiliki keelektronegatifan yang sama, maka pasangan elektron berada di tengah-tengah di antara A dan B
B memiliki keelektronegatifan lebih besar dari A
![]()
Karena B memiliki keelektronegatifan lebih besar dari A, maka pasangan elektron akan lebih dekat ke B
Dalam satu periode
Semakin ke arah kanan, keelektronegatifan akan semakin besar. Hal ini disebabkan semakin ke arah kanan, semakin banyak muatan positif (proton) di dalam inti, sehingga gaya tarik inti terhadap elektron semakin besar. Karena gaya tarik inti semakin besar, maka semakin mudah untuk menarik pasangan elektron.
Golongan VIIIA dikecualikan karena golongan VIIIA sudah dalam kondisi stabil dan tidak membentuk ikatan dengan unsur lainnya.
Dalam satu golongan
Semakin ke arah bawah, afinitas elektron akan semakin kecil. Hal ini disebabkan semakin ke arah bawah, radius atom semakin besar sehingga gaya tarik inti semakin kecil. Karena gaya tarik inti semakin kecil, maka semakin sulit untuk menarik pasangan elektron.
Nilai keelektronegatifan terbesar dimiliki oleh unsur Fluorine
SIFAT LOGAM
Sifat logam ditentukan oleh kecenderungan suatu unsur melepaskan elektron.
Dalam satu periode
Semakin ke arah kanan, sifat logam akan semakin kecil. Hal ini disebabkan semakin ke arah kanan, gaya tarik inti semakin besar sehingga semakin sulit untuk melepas elektron.
Dalam satu golongan
Semakin ke arah bawah, sifat logam akan semakin besar. Hal ini disebabkan semakin ke arah bawah, gaya tarik inti semakin kecil sehingga semakin mudah untuk melepas elektron.
SIFAT NON LOGAM
Sifat non logam ditentukan oleh kecenderungan suatu unsur menarik elektron.
Dalam satu periode
Semakin ke arah kanan, sifat non logam akan semakin besar. Hal ini disebabkan semakin ke arah kanan, gaya tarik ini semakin besar sehingga semakin mudah untuk menarik elektron.
Dalam satu golongan
Semakin ke arah bawah, sifat non logam akan semakin kecil. Hal ini disebabkan semakin ke arah bawah, gaya tarik inti semakin kecil sehingga semakin sulit untuk menarik elektron.
Kereaktifan Unsur
Kereaktifan unsur logam
Kereaktifan unsur logam ditentukan oleh nilai energi ionisasinya. Semakin besar energi ionisasi (semakin besar energi yang dibutuhkan untuk melepas elektron), maka semakin sulit reaksi terjadi/semakin tidak reaktif.
Kereaktifan unsur non logam
Kereaktifan unsur non logam ditentukan oleh nilai afinitas elektron. Semakin besar afinitas elektron, semakin mudah unsur bereaksi.
