Reaksi Kesetimbangan
A. Reaksi Kesetimbangan
Reaksi kesetimbangan adalah reaksi yang berjalan dalam dua arah, dimana zat-zat hasil reaksi (produk) dapat bereaksi kembali membentuk zat sebelum reaksi (reaktan).
\(\ce{A + B <=> C}\)
Ciri-ciri reaksi kesetimbangan:
- reaksi berjalan dalam sistem tertutup
- bersifat reversible (reaksi berjalan dalam dua arah dengan laju reaksi yang sama)
- bersifat dinamis (reaksi berjalan terus walaupun posisi kesetimbangan sudah tercapai)
- bersifat mikroskopis
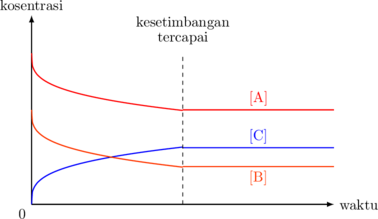
Grafik Konsentrasi vs Waktu
Grafik Laju Reaksi vs Waktu
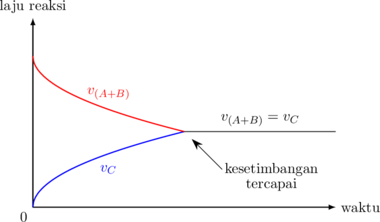
Mula-mula hanya ada zat A dan B. Dengan berjalannya reaksi, konsentrasi A dan B semakin berkurang, sehingga laju reaksinya bertambah kecil.
Sebaliknya untuk zat C, mula-mula belum ada. Dengan berjalannya reaksi, konsentrasi C bertambah banyak, sehingga laju reaksinya bertambah besar.
Pada suatu waktu, laju reaksi A dan B sama dengan laju reaksi C. Pada titik ini, posisi kesetimbangan tercapai, dan konsentrasi setiap zatnya tidak berubah.
B. Tetapan Kesetimbangan Konsentrasi (Kc)
Pada reaksi:
\(\ce{p A(aq) + q B(l) <=> r C(g) + s D(s)}\)
Tetapan kesetimbangan berdasarkan konsentrasi zat adalah
\(K_c = \dfrac {[C]^r}{[A]^p}\)
Tetapan kesetimbangan berdasarkan konsentrasi hanya dihitung dari zat-zat berwujud larutan (aq) dan gas.
Nilai tetapan kesetimbangan tidak dipengaruhi oleh perubahan tekanan dan volume zat, namun dipengaruhi oleh perubahan suhu.
Kc dan Perubahan Suhu
Perhatikan reaksi di bawah ini:
\(\ce{A (g) + B (g) <=> C (g) \quad \Delta H = + 100 \text{ kJ}}\)
\(K_c = \dfrac {[C]}{[A] \: [B]}\)
Reaksi di atas menunjukkan bahwa reaksi ke arah kanan merupakan reaksi endoterm dan reaksi ke arah kiri merupakan reaksi eksoterm.
Saat suhu dinaikkan, reaksi akan bergeser ke arah endoterm (ke arah kanan) sehingga konsentrasi zat C akan bertambah dan konsentrasi zat A dan B akan berkurang, yang menyebabkan nilai Kc akan semakin besar.
Sebaliknya, saat suhu diturunkan, reaksi akan bergeser ke arah eksoterm (ke arah kiri) sehingga konsentrasi zat C akan berkurang dan konsentrasi zat A dan B akan bertambah, yang menyebabkan nilai Kc akan semakin kecil.
Menentukan Apakah Suatu Reaksi Sudah Mencapai Kesetimbangan
Diketahui suatu reaksi yang sedang berlangsung \(\ce{A (g) + B (g) <=> C (g) \quad Kc = K}\)
Pada suatu waktu, jumlah zat A, B dan C adalah [A], [B] dan [C]. Apakah pada saat ini zat-zat sudah berada dalam kesetimbangan?
Kita dapat menghitung nilai tetapan sementara \(Q_c = \dfrac {[C]}{[A] \: [B]}\)
(1) Jika \(Q_c = K_c\) maka reaksi sudah mencapai kesetimbangan.
(2) Jika \(Q_c < K_c\) maka reaksi belum mencapai kesetimbangan, nilai \(Q_c\) akan meningkat untuk mencapai nilai \(K_c\) sehingga reaksi masih berlangsung ke arah kanan.
(3) Jika \(Q_c > K_c\) maka reaksi belum mencapai kesetimbangan, nilai \(Q_c\) akan menurun untuk mencapai nilai \(K_c\) sehingga reaksi masih berlangsung ke arah kiri.
Kc dan Manipulasi Reaksi
1. Reaksi yang dibalik
\(\ce{A (g) + B (g) <=> C (g) \quad Kc = K}\)
\(\ce{C (g) <=> A (g) + B (g) \quad Kc = \dfrac {1}{K}}\)
Pembuktian
Pada reaksi \(\ce{A (g) + B (g) <=> C (g) \rightarrow Kc = \dfrac {[C]}{[A] \: [B]} = K}\)
Pada reaksi \(\ce{C (g) <=> A (g) + B (g) \rightarrow Kc = \dfrac {[A] \: [B]}{[C]} = \dfrac {1}{K}}\)
2. Reaksi yang dikali n
\(\ce{A (g) + B (g) <=> C (g) \quad Kc = K}\)
\(\ce{n A (g) + n B (g) <=> n C (g) \quad Kc = K^n}\)
Pembuktian
Pada reaksi \(\ce{A (g) + B (g) <=> C (g) \rightarrow Kc = \dfrac {[C]}{[A] \: [B]} = K}\)
Pada reaksi \(\ce{n A (g) + n B (g) <=> n C (g)}\)
\begin{equation*} \begin{split} Kc = \frac {[C]^n}{[A]^n \: [B]^n} = \left(\frac {[C]}{[A] \: [B]}\right)^n = K^n \end{split} \end{equation*}
3. Dua reaksi yang dijumlahkan
\begin{equation*} \begin{split} \ce{A (g) + B (g) & <=> C (g) \quad Kc = K_1} \\\\ \ce{C (g) + D (g) & <=> E (g) \quad Kc = K_2} \quad (+) \\\\ \hline \\ \ce{A (g) + B (g) + D (g) & <=> E (g) \quad K_3 = K_1 \:.\: K_2} \end{split} \end{equation*}
Pembuktian
Pada reaksi \(\ce{A (g) + B (g<=> C (g) \rightarrow Kc = \dfrac {[C]}{[A] \: [B]} = K_1}\)
Pada reaksi \(\ce{C (g) + D (g) <=> E (g) \rightarrow Kc = \dfrac {[E]}{[C] \: [D]} = K_2}\)
Pada reaksi \(\ce{A (g) + B (g) + D (g) <=> E (g) \rightarrow Kc = \dfrac {[E]}{[A] \: [B] \: [D]} = K_3}\)
\begin{equation*} \begin{split} K_1 \:.\: K_2 & =\frac {[C]}{[A] \: [B]} \:.\: \frac {[E]}{[C] \: [D]} \\\\ K_1 \:.\: K_2 & = \dfrac {[E]}{[A] \: [B] \: [D]} \\\\ K_1 \:.\: K_2 & = K_3 \end{split} \end{equation*}
C. Tetapan Kesetimbangan Tekanan (Kp)
Pada reaksi:
\(\ce{p A(g) + q B(aq) <=> r C(g) + s D(s)}\)
Tetapan kesetimbangan berdasarkan tekanan adalah:
\(K_p = \dfrac {[P_C]^r}{[P_A]^p}\)
Tetapan kesetimbangan berdasarkan tekanan hanya dihitung dari zat-zat berwujud gas.
D. Hubungan Kc dan Kp
Hubungan antara nilai Kc dan Kp adalah:
\(K_p = K_c \: (R \:.\: T)^{\Delta n}\)
R = 0,082
T = suhu dalam K = ºC + 273
\(\Delta n = \Sigma \text{(Koefisien reaksi produk}) - \Sigma \text{(Koefisien reaksi reaktan)}\)
SOAL LATIHAN

