Konsep Mol
A. Konsep Mol
Mol dan jumlah partikel
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{N}}{\text{N}_{\text{A}}}}\)
N = jumlah partikel (atom atau molekul)
NA = bilangan Avogadro \(6,02 \times 10^{23}\)
Mol dan massa zat
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{m}}{\text{Ar}}}\) atau \(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{m}}{\text{Mr}}}\)
m = massa zat
Ar = massa atom relatif
Mr = massa molekul relatif
Mol dan volume gas pada kondisi STP 0ºC dan 1 atm
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{V}}{22,4}}\)
(Khusus gas)
Mol dan volume gas pada kondisi RTP 25ºC dan 1 atm
\(\bbox[5px, border: 2px solid red] {\text{n} = \dfrac {\text{V}}{24,4}}\)
(Khusus gas)
Mol dan Konsentrasi
\(\bbox[5px, border: 2px solid red] {\text{n} = \text{V} \:.\: \text{M}}\)
M = konsentrasi (molaritas)
Konsentrasi Molar
\(\bbox[5px, border: 2px solid red] {\text{M} = \dfrac {\rho \:.\: \% \:.\: 10}{\text{Mr}}}\)
ρ = massa jenis (gr/mL)
% = persentase massa
B. Persamaan Gas Ideal
\(\bbox[5px, border: 2px solid red] {\text{P} \:.\: \text{V} = \text{n} \:.\: \text{R} \:.\: \text{T}}\)
P = tekanan gas (dalam satuan atm)
1 atm = 76 cmHg
V = volume gas (dalam satuan liter)
1 liter = 1 dm³
T = suhu gas (dalam satuan Kelvin)
Kelvin = Celcius + 273
n = jumlah mol gas
R = konstanta = 0,082
C. Atom dan Molekul
Atom merupakan partikel terkecil yang tidak dapat dipisahkan dengan cara kimia biasa.
![]()
Atom
Molekul merupakan gabungan dari beberapa atom. Ada 2 macam molekul, yaitu molekul unsur dan molekul senyawa. Molekul unsur adalah molekul yang terdiri atas 1 jenis unsur saja, sedangkan molekul senyawa terdiri atas 2 atau lebih unsur berbeda.
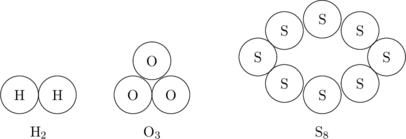
Molekul unsur
Molekul yang terdiri dari satu jenis unsur saja
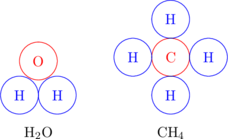
Molekul senyawa
Molekul yang terdiri dari 2 atau lebih unsur berbeda
Contoh:
Tentukan jumlah atom masing-masing unsur dalam 3 molekul \(\ce{H2O}\).
3 molekul \(\ce{H2O}\) dapat ditulis sebagai \(\ce{3 H2O}\)
Banyaknya atom \(\ce{H}\) = \(3 \times 2 = 6\) atom \(\ce{H}\)
Banyaknya atom \(\ce{O}\) = \(3 \times 1 = 3\) atom \(\ce{O}\)
SOAL LATIHAN

