A. Bilangan Oksidasi
Penentuan Bilangan Oksidasi Unsur (diurutkan berdasarkan prioritas)
(1) Dalam senyawa atau ion, bilangan oksidasi F sama dengan −1
(2) Dalam senyawa atau ion, bilangan oksidasi logam selalu bernilai positif
Logam golongan IA → +1
Logam golongan IIA → +2
Logam golongan IIIA → +3
(3) Unsur pada atom netral dan molekul unsur memiliki bilangan oksidasi nol
\(\ce{Na = 0}\)
\(\ce{O2 = 0}\)
(4) Jumlah bilangan oksidasi unsur-unsur pada senyawa sama dengan nol
\(\ce{PCl5}\)
bilangan oksidasi P + (5 × Cl) = 0
\(\ce{CO2}\)
bilangan oksidasi C + (2 × O) = 0
(5) Unsur pada ion tunggal memiliki bilangan oksidasi sama dengan muatannya
\(\ce{Mg^{2+} = +2}\)
\(\ce{Cl− = -1}\)
(6) Jumlah bilangan oksidasi unsur-unsur pada molekul ion sama dengan muatannya
\(\ce{NH4+ }\)
bilangan oksidasi N + (4 × H) = +1
\(\ce{SO4^{2-} }\)
bilangan oksidasi S + (4 × O) = −2
(7) Dalam senyawa atau ion, bilangan oksidasi unsur hidrogen bernilai +1
(8) Dalam senyawa atau ion, bilangan oksidasi unsur oksigen bernilai −2
B. Perkembangan reaksi redoks
Reaksi redoks merupakan singkatan dari reaksi oksidasi dan reaksi reduksi. Kedua reaksi ini mengalami perubahan arti dari waktu ke waktu.
1. Reaksi redoks sebagai reaksi pengikatan dan pelepasan oksigen
Reaksi oksidasi adalah reaksi pengikatan oksigen.
Contoh:
\(\ce{C(s) + O2(g) -> CO2(g)}\)
\(\ce{N2(g) + O2(g) -> 2 NO(g)}\)
Reaksi reduksi adalah reaksi pelepasan oksigen.
Contoh:
\(\ce{CO2(g) -> C(s) + O2(g)}\)
\(\ce{2 NO(g) -> N2(g) + O2(g)}\)
2. Reaksi redoks sebagai pengikatan dan pelepasan elektron
Reaksi oksidasi adalah reaksi pelepasan elektron.
Contoh:
\(\ce{Mg(s) -> Mg^{2+}(aq) + 2e}\)
\(\ce{Al(s) -> Al^{3+}(aq) + 3e}\)
Reaksi reduksi adalah reaksi pengikatan elektron.
Contoh:
\(\ce{Mg^{2+}(aq) + 2e -> Mg(s)}\)
\(\ce{Al^{3+}(aq) + 3e -> Al(s)}\)
3. Reaksi redoks sebagai kenaikan dan penurunan bilangan oksidasi
Reaksi oksidasi adalah reaksi kenaikan bilangan oksidasi dan reaksi reduksi adalah reaksi penurunan bilangan oksidasi. Pada tahap ini, reaksi oksidasi dan reaksi reduksi merupakan satu kesatuan reaksi, sehingga setiap ada reaksi oksidasi, akan ada reaksi reduksi.
Contoh:
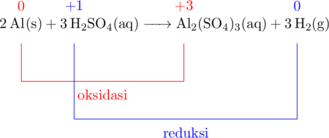
\(\ce{Al(s) + H2SO4(aq) -> Al2(SO4)3(aq) + H2(g)}\)
Bilangan oksidasi \(\ce{Al}\) pada atom \(\ce{Al}\) adalah 0 dan pada senyawa \(\ce{Al2(SO4)3}\) adalah +3, sehingga \(\ce{Al}\) mengalami oksidasi.
Bilangan oksidasi \(\ce{H}\) pada atom \(\ce{H2SO4}\) adalah +1 dan pada senyawa \(\ce{H2}\) adalah 0, sehingga \(\ce{H}\) mengalami reduksi.
Reduktor dan Oksidator
Reduktor adalah zat yang mengalami oksidasi dan hasil reaksinya disebut hasil oksidasi.
Oksidator adalah zat yang mengalami reduksi dan hasil reaksinya disebut hasil reduksi.
Reaksi disproporsionasi adalah reaksi redoks dimana reduktor dan oksidator merupakan zat yang sama.
Reaksi konproporsionasi adalah reaksi redoks dimana hasil oksidasi dan hasil reduksi merupakan zat yang sama.
Reaksi redoks biasa
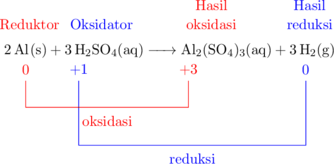
Reduktor: \(\ce{Al}\)
Hasil oksidasi: \(\ce{Al2(SO4)3}\)
Oksidator: \(\ce{H2SO4}\)
Hasil reduksi: \(\ce{H2}\)
Reaksi disproporsionasi
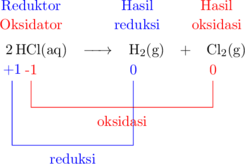
Reaksi disproporsionasi adalah jenis reaksi redoks dimana reduktor dan oksidator merupakan zat yang sama.
Reduktor: \(\ce{HCl}\)
Hasil oksidasi: \(\ce{HCl}\)
Oksidator: \(\ce{Cl2}\)
Hasil reduksi: \(\ce{H2}\)
Reaksi konproporsionasi
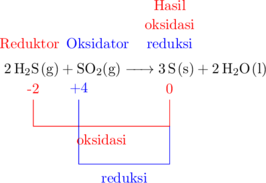
Reaksi konproporsionasi adalah jenis reaksi redoks dimana hasil oksidasi dan hasil reduksi merupakan zat yang sama.
Reduktor: \(\ce{H2S}\)
Hasil oksidasi: \(\ce{SO2}\)
Oksidator: \(\ce{S}\)
Hasil reduksi: \(\ce{S}\)

