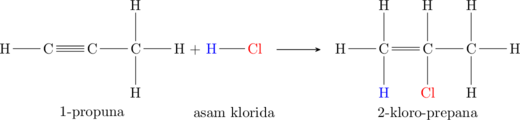Sifat-sifat Senyawa Hidrokarbon
Sifat-sifat senyawa hidrokarbon terdiri atas sifat fisis dan sifat kimia. Sifat fisis terdiri atas titik beku, titik didih dan kelarutan senyawa hidrokarbon. Sedangkan sifat kimia berupa reaksi-reaksi yang bisa terjadi pada senyawa hidrokarbon.
A. Sifat Fisis Senyawa Hidrokarbon
Sifat-sifat umum senyawa hidrokarbon:
-
- tidak berwarna
- mudah terbakar
- nonpolar, sehingga tidak larut dalam pelarut nonpolar termasuk air
- Semakin banyak atom C, titik beku dan titik didih akan semakin tinggi
- Senyawa dengan rantai bercabang memiliki titik beku dan titik didih lebih rendah daripada rantai lurus pada jumlah atom C yang sama
- Wujud pada suhu ruang
- Alkana rantai lurus \(\ce{C1}\) - \(\ce{C4}\) berwujud gas
- Alkana rantai lurus \(\ce{C4}\) - \(\ce{C16}\) berwujud cair
- Alkana rantai lurus \(\ce{C17}\) - ... berwujud padat, dan umumnya lunak
B. Sifat Kimia pada Alkana
1. Reaksi pembakaran
Reaksi pembakaran merupakan reaksi senyawa dengan gas oksigen \(\ce{O2}\)
Pembakaran sempurna senyawa hidrokarbon akan menghasilkan gas \(\ce{CO2}\) dan \(\ce{H2O}\)
\(\ce{CxHy + O2 -> CO2 + H2O}\)
Pembakaran yang tidak sempurna akan menghasilkan \(\ce{C}\), \(\ce{CO}\) dan \(\ce{H2O}\)
\(\ce{CxHy + O2 -> C + CO + H2O}\)
Gas \(\ce{CO}\) yang dihasilkan pada pembakaran tidak sempurna bersifat racun bagi pernafasan.
2. Reaksi substitusi dengan gas halogen (halogenasi) dengan pemanasan atau uv light
Reaksi substitusi merupakan reaksi pergantian atom pada senyawa hidrokarbon dengan atom lain
Reaksi halogenasi pada alkana dilakukan dengan pemanasan atau pencahayaan sinar ultraviolet (uv light)


3. Reaksi perengkahan (cracking)
Reaksi pemisahan rantai panjang menjadi rantai yang lebih pendek
\(\ce{C14H30 -> C7H16 + C7H14}\)
C. Sifat-sifat Kimia pada Alkena
1. Reaksi oksidasi
Reaksi oksidasi pada alkena menggunakan gas \(\ce{O2}\) (pembakaran) atau oksidator kuat seperti \(\ce{KMnO4}\) atau \(\ce{K2Cr2O7}\)
Pembakaran sempurna senyawa alkena dengan gas \(\ce{O2}\) akan menghasilkan gas \(\ce{CO2}\) dan \(\ce{H2O}\)
\(\ce{CxHy + O2 -> CO2 + H2O}\)
Pembakaran yang tidak sempurna akan menghasilkan \(\ce{C}\), \(\ce{CO}\) dan \(\ce{H2O}\)
\(\ce{CxHy + O2 -> C + CO + H2O}\)
Gas \(\ce{CO}\) yang dihasilkan pada pembakaran tidak sempurna bersifat racun bagi pernafasan.
2. Reaksi adisi
Reaksi adisi merupakan reaksi pemecahan ikatan rangkap untuk mengikat atom lain
(a) Hidrogenasi
Hidrogenasi merupakan reaksi adisi dengan gas hidrogen. Satu ikatan pada ikatan rangkap terputus untuk mengikat dua atom hidrogen.

(b) Halogenasi
Halogenasi merupakan reaksi adisi dengan gas halogen \(\ce{Cl2, Br2, I2}\).
Satu ikatan pada ikatan rangkap terputus untuk mengikat dua atom halogen.

(c) Hidrohalogenasi
Hidrohalogenasi merupakan reaksi adisi dengan gas asam halida \(\ce{HCl, HBr, HI}\)
Satu ikatan pada ikatan rangkap terputus untuk mengikat atom hidrogen dan atom halogen.
Atom C yang mengikat atom hidrogen kemungkinan besar adalah atom C yang lebih banyak mengikat atom hidrogen sebelumnya (Markovnikov rule).
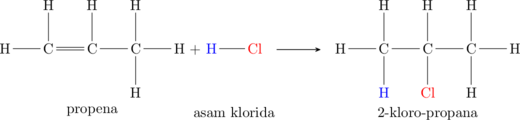
(d) Hidrasi
Hidrasi merupakan reaksi adisi dengan molekul air \(\ce{H2O}\) dengan katalis \(\ce{H2SO4}\).
Hidrasi pada senyawa alkena akan menghasilkan alkohol.
![]()
5. Polimerisasi
Reaksi polimerisasi merupakan reaksi penggabungan banyak senyawa alkena menjadi satu senyawa dengan rantai sangat panjang
![]()
D. Sifat-sifat Kimia pada Alkuna
Seacara umum, reaksi pada senyawa alkuna sama seperti reaksi pada senyawa alkena.
1. Reaksi oksidasi
Reaksi oksidasi pada alkena menggunakan gas \(\ce{O2}\) (pembakaran) atau oksidator kuat seperti \(\ce{KMnO4}\) atau \(\ce{K2Cr2O7}\)
Pembakaran sempurna senyawa alkena dengan gas \(\ce{O2}\) akan menghasilkan gas \(\ce{CO2}\) dan \(\ce{H2O}\)
\(\ce{CxHy + O2 -> CO2 + H2O}\)
Pembakaran yang tidak sempurna akan menghasilkan C, CO dan H2O
\(\ce{CxHy + O2 -> C + CO + H2O}\)
Gas CO yang dihasilkan pada pembakaran tidak sempurna bersifat racun bagi pernafasan.
2. Reaksi adisi
Reaksi adisi merupakan reaksi pemecahan ikatan rangkap untuk mengikat atom lain
(a) Hidrogenasi
Hidrogenasi merupakan reaksi adisi dengan gas hidrogen. Satu ikatan pada ikatan rangkap terputus untuk mengikat dua atom hidrogen.

(b) Halogenasi
Halogenasi merupakan reaksi adisi dengan gas halogen \(\ce{Cl2, Br2, I2}\).
Satu ikatan pada ikatan rangkap terputus untuk mengikat dua atom halogen.
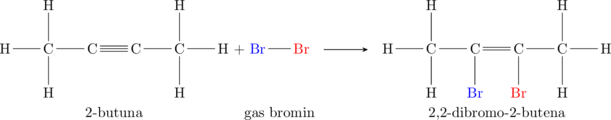
(c) Hidrohalogenasi
Hidrohalogenasi merupakan reaksi adisi dengan gas asam halida \(\ce{HCl, HBr, HI}\)
Satu ikatan pada ikatan rangkap terputus untuk mengikat atom hidrogen dan atom halogen.
Atom C yang mengikat atom hidrogen kemungkinan besar adalah atom C yang lebih banyak mengikat atom hidrogen sebelumnya (Markovnikov rule).