Teori Oksidasi dan Reduksi
Reaksi redoks merupakan singkatan dari reaksi oksidasi dan reaksi reduksi. Kedua reaksi ini mengalami perubahan arti dari waktu ke waktu.
Perkembangan reaksi redoks
1. Reaksi redoks sebagai reaksi pengikatan dan pelepasan oksigen
Reaksi oksidasi adalah reaksi pengikatan oksigen.
Contoh:
\(\ce{C(s) + O2(g) -> CO2(g)}\)
\(\ce{N2(g) + O2(g) -> 2 NO(g)}\)
Reaksi reduksi adalah reaksi pelepasan oksigen.
Contoh:
\(\ce{CO2(g) -> C(s) + O2(g)}\)
\(\ce{2 NO(g) -> N2(g) + O2(g)}\)
2. Reaksi redoks sebagai pengikatan dan pelepasan elektron
Reaksi oksidasi adalah reaksi pelepasan elektron.
Contoh:
\(\ce{Mg(s) -> Mg^{2+}(aq) + 2e}\)
\(\ce{Al(s) -> Al^{3+}(aq) + 3e}\)
Reaksi reduksi adalah reaksi pengikatan elektron.
Contoh:
\(\ce{Mg^{2+}(aq) + 2e -> Mg(s)}\)
\(\ce{Al^{3+}(aq) + 3e -> Al(s)}\)
3. Reaksi redoks sebagai kenaikan dan penurunan bilangan oksidasi
Reaksi oksidasi adalah reaksi kenaikan bilangan oksidasi dan reaksi reduksi adalah reaksi penurunan bilangan oksidasi. Pada tahap ini, reaksi oksidasi dan reaksi reduksi merupakan satu kesatuan reaksi, sehingga setiap ada reaksi oksidasi, akan ada reaksi reduksi.
Contoh:
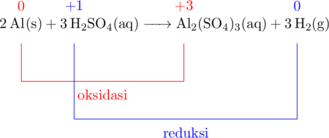
\(\ce{Al(s) + H2SO4(aq) -> Al2(SO4)3(aq) + H2(g)}\)
Bilangan oksidasi \(\ce{Al}\) pada atom \(\ce{Al}\) adalah 0 dan pada senyawa \(\ce{Al2(SO4)3}\) adalah +3, sehingga \(\ce{Al}\) mengalami oksidasi.
Bilangan oksidasi \(\ce{H}\) pada atom \(\ce{H2SO4}\) adalah +1 dan pada senyawa \(\ce{H2}\) adalah 0, sehingga \(\ce{H}\) mengalami reduksi.
SOAL LATIHAN

