Autoredoks
Autoredoks adalah zat yang mengalami reaksi oksidasi dan reduksi bersamaan.
Contoh:
\(\ce{Cl2 (g) + NaOH (aq) -> NaCl (aq) + NaClO (aq) + H2O (l)}\)
Metode Bilangan Oksidasi
(1) Menentukan bilangan oksidasi unsur-unsur yang berubah
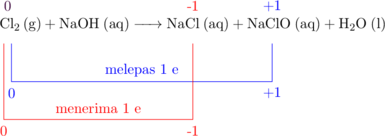
Bilangan oksidasi yang berubah adalah Cl
![]()
Bilangan oksidasi Cl berubah dari 0 menjadi −1 dan +1, sehingga Cl mengalami oksidasi sekaligus reduksi
(3) Menentukan besar perubahan bilangan oksidasi
(4) Menyetarakan jumlah atom Na
\(\ce{Cl2 (g) + 2 NaOH (aq) -> NaCl (aq) + NaClO (aq) + H2O (l)}\)
Metode ½ Reaksi
(1) Menentukan bilangan oksidasi unsur-unsur yang berubah
Bilangan oksidasi yang berubah adalah Cl
![]()
Bilangan oksidasi Cl berubah dari 0 menjadi −1 dan +1, sehingga Cl mengalami oksidasi sekaligus reduksi
(2) Membuat reaksi oksidasi dan reaksi reduksi
\begin{array} {lll} \ce {Oksidasi: & Cl2 (g) & -> ClO- (aq)} \\\\ \ce {Reduksi: & Cl2 (g) & -> Cl- (aq)} \end{array}
(3) Menyetarakan jumlah atom Cl
\begin{array} {lll} \ce {Oksidasi: & Cl2 (g) & -> 2 ClO- (aq)} \\\\ \ce {Reduksi: & Cl2 (g) & -> 2 Cl- (aq)} \end{array}
(4) Menyetarakan jumlah atom O dengan menambahkan \(\ce{H2O}\)
\begin{array} {lll} \ce {Oksidasi: & Cl2 (g) + 2 H2O (l) & -> 2 ClO- (aq)} \\\\ \ce {Reduksi: & Cl2 (g) & -> 2 Cl- (aq)} \end{array}
(5) Menyetarakan jumlah H dengan menambahkan \(\ce{H+}\)
\begin{array} {lll} \ce {Oksidasi: & Cl2 (g) + 2 H2O (l) & -> 2 ClO- (aq) + 4H+ (aq)} \\\\ \ce {Reduksi: & Cl2 (g) & -> 2 Cl- (aq)} \end{array}
(6) Menambahkan ion \(\ce{OH-}\) pada kedua ruas (suasana basa)
\begin{array} {lll} \ce {Oksidasi: & Cl2 (g) + 2 H2O (l) + 4 OH- (aq) & -> 2 ClO- (aq) + 4H+ (aq) + 4 OH- (aq)} \\\\ \ce {Oksidasi: & Cl2 (g) + 2 H2O (l) + 4 OH- (aq) & -> 2 ClO- (aq) + 4H2O (l)} \\\\ \ce {Oksidasi: & Cl2 (g) + 4 OH- (aq) & -> 2 ClO- (aq) + 2H2O (l)} \\\\ \ce {Reduksi: & Cl2 (g) & -> 2 Cl- (aq)} \end{array}
(7) Menyetarakan jumlah muatan dengan menambahkan elektron
\begin{array} {lll} \ce {Oksidasi: & Cl2 (g) + 4 OH- (aq) & -> 2 ClO- (aq) + 2H2O (l) + 2e} \\\\ \ce {Reduksi: & Cl2 (g) + 2e & -> 2 Cl- (aq)} \end{array}
(8) Menyetarakan jumlah elektron yang dilepas dan diterima
\begin{array} {llll} \ce {Oksidasi: & Cl2 (g) + 4 OH- (aq) & -> 2 ClO- (aq) + 2H2O (l) + 2e} & \times 1 \\\\ \ce {Reduksi: & Cl2 (g) + 2e & -> 2 Cl- (aq)} & \times 1 \\\\ \hline \\ \ce{ & 2 Cl2 (g) + 4 OH- (aq) & -> 2 ClO- (aq) + 2 Cl- (aq) + 2H2O (l)} \\\\ \ce{ & Cl2 (g) + 2 OH- (aq) & -> ClO- (aq) + Cl- (aq) + H2O (l)} \end{array}
(9) Menambahkan ion \(\ce{Na+}\) pada kedua ruas
\begin{array} {llll} \ce{ & Cl2 (g) + 2 OH- (aq) + 2 Na+ (aq) & -> ClO- (aq) + Cl- (aq) + H2O (l) + 2 Na+ (aq)} \\\\ \ce{ & Cl2 (g) + 2 NaOH (aq) & -> NaClO (aq) + NaCl (aq) + H2O (l) } \end{array}
SOAL LATIHAN
