Metode Bilangan Oksidasi
\(\ce{Cr2O7^2- (aq) +C2O4^2- (aq) -> Cr^3+ (aq) + CO2 (g)}\) (suasana asam)
(1) Menentukan bilangan oksidasi unsur-unsur yang berubah
Bilangan oksidasi yang berubah adalah Cr dan C
![]()
Bilangan oksidasi C berubah dari +3 menjadi +4, sehingga C mengalami oksidasi
Bilangan oksidasi Cr berubah dari +6 menjadi +3, sehingga Cr mengalami reduksi
(2) Menyetarakan jumlah atom dari unsur yang bilangan oksidasinya berubah
Menyetarakan jumlah atom Cr dan C dengan menambahkan koefisien reaksi
\(\ce{Cr2O7^{2–}(aq) + C2O4^{2–}(aq) -> 2 Cr^{3+}(aq) + 2 CO2 (g) }\)
(3) Menentukan besar perubahan bilangan oksidasi
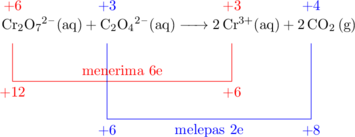
(4) Menyetarakan jumlah elektron
Jumlah elektron yang diterima oleh Cr adalah 6e, dan jumlah elektron yang dilepas oleh C adalah 2e. Agar jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima, maka koefisien \(\ce{C2O4^2-}\) dan \(\ce{CO2}\) dikali 3.
\(\ce{Cr2O7^{2–}(aq) + 3 C2O4^{2–}(aq) -> 2 Cr^{3+}(aq) + 6 CO2 (g) }\);
(5) Menyetarakan jumlah atom oksigen dengan menambahkan H2O
\(\ce{Cr2O7^2- (aq) + 3 C2O4^2- (aq) -> 2 Cr^3+ (aq) + 6 CO2 (g) + 7 H2O (l)}\)
(6) Menyetarakan jumlah atom H dengan menambahkan ion H+
\(\ce{Cr2O7^2- (aq) + 3 C2O4^2- (aq) + 14 H+ (aq) -> 2 Cr^3+ (aq) + 6 CO2 (g) + 7 H2O (l)}\)
(7) Cek jumlah muatan
+6 = +6 (OK!)
SOAL LATIHAN
