Energi Ikat
Energi ikat adalah energi rata-rata yang dibutuhkan untuk memutus sebuah ikatan dari seluruh ikatan suatu molekul gas menjadi atom-atom gas.
\(\ce{CH4(g) -> CH3(g) + H(g) \quad \Delta H = 425 \text{ kJ/mol}}\)
\(\ce{CH3(g) -> CH2(g) + H(g) \quad \Delta H = 480 \text{ kJ/mol}}\)
\(\ce{CH2(g) -> CH(g) + H(g) \quad \Delta H = 425 \text{ kJ/mol}}\)
\(\ce{CH(g) -> C(g) + H(g) \quad \Delta H = 335 \text{ kJ/mol}}\)
Energi ikat rata-rata \(\ce{C - H}\) adalah rata-rata dari keempat nilai di atas, yaitu 413 kJ/mol.
Reaksi kimia adalah penyusunan ulangan ikatan-ikatan dalam molekul. Setiap reaksi kimia terdiri atas dua proses:
1. Proses pemutusan ikatan lama
Pemutusan ikatan antar atom membutuhkan energi → ΔH pemutusan
2. Proses pembentukan ikatan baru
Pembentukan ikatan baru akan melepaskan energi → ΔH pengikatan
Proses pemutusan dan pengikatan antar atom berlangsung dalam wujud gas.

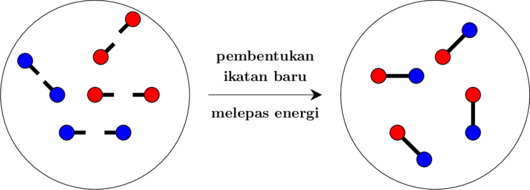
Energi Ikat dan Perubahan Entalpi
\(\Delta H = \Delta H_{\text{pemutusan}} - \Delta H_{\text{pengikatan}}\)
\(\Delta H = \Delta H_{\text{reaktan}} - \Delta H_{\text{produk}}\)
Besarnya \(\Delta H\) pemutusan dan \(\Delta H\) pengikatan dapat diketahui dari tabel energi ikat.
SOAL LATIHAN

