Entalpi
Entalpi adalah jumlah energi panas (kalor) yang terkandung dalam suatu sistem. Bila dalam sistem tersebut terjadi reaksi kimia, maka akan terjadi perubahan dalam entalpi.
Reaksi kimia adalah penyusunan ulangan ikatan-ikatan dalam molekul. Setiap reaksi kimia terdiri atas dua proses:
1. Proses pemutusan ikatan lama
Pemutusan ikatan antar atom membutuhkan energi → ΔH pemutusan
2. Proses pembentukan ikatan baru
Pembentukan ikatan baru akan melepaskan energi → ΔH pengikatan

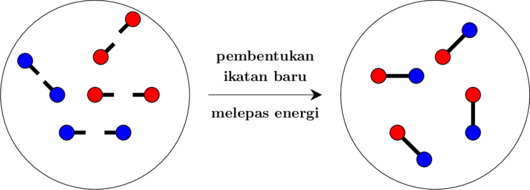
Besarnya perubahan entalpi dalam suatu reaksi tergantung pada nilai ΔH pemutusan dan ΔH pengikatan:
-
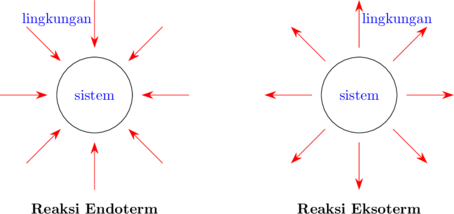
- Bila ΔH pemutusan > ΔH pengikatan, maka entalpi sistem akan bertambah dan reaksinya disebut reaksi endoterm. Pada reaksi endoterm, terjadi perpindahan energi dari lingkungan ke sistem.
- Bila ΔH pemutusan < ΔH pengikatan, maka entalpi sistem akan berkurang dan reaksinya disebut reaksi eksoterm. Pada reaksi eksoterm, terjadi perpindahan energi dari sistem ke lingkungan.
Energi Aktivasi
Untuk dapat memutus ikatan antar atomnya, molekul harus melakukan perubahan bentuk dalam suatu kondisi yang disebut transition state. Kondisi transition state membutuhkan energi lebih besar yang perlu ditambahkan agar pemutusan ikatan dapat berlangsung. Energi tersebut dinamakan energi aktivasi \(E_A\)

Reaksi endoterm

Reaksi eksoterm
Katalis
Semakin besar energi aktivasi yang dibutuhkan, semakin lambat proses reaksi berjalan. Untuk dapat mempercepat reaksi, nilai energi aktivasi dapat diturunkan dengan menggunakan katalis tertentu. Katalis berfungsi untuk memecah reaksi dalam tahap-tahap reaksi yang lebih cepat.
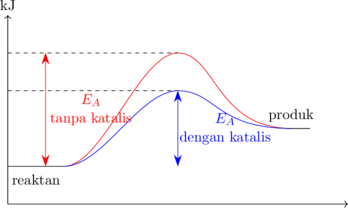
Adanya katalis dapat menurunkan nilai energi aktivasi, yang dapat mempercepat proses reaksi, namun tidak mengubah nilai \(\Delta H\) reaksi tersebut.
Jenis-jenis Perubahan Entalpi
1. ΔH° Pembentukan \((\Delta H_f^o)\)
Energi yang menyertai pembentukan 1 mol senyawa dari unsur-unsurnya pada tekanan 1 atm dan suhu 25°C.
Contoh:
(1) \(\ce{C(s) + 2 H2(g) -> CH4(g) \quad \Delta H_f^o = -74.9 kJ/mol}\)
(2) \(\ce{H2(g) + \frac{1}{2} O2(g) -> H2O(l) \quad \Delta H_f^o = -285.8 kJ/mol}\)
(3) \(\ce{\frac{1}{2} N2(g) + \frac{3}{2} H2(g) -> NH3(g) \quad \Delta H_f^o = -46.1 kJ/mol}\)
Beberapa hal yang harus diperhatikan:
-
- koefisien reaksi pada molekul yang terbentuk harus 1, menunjukkan bahwa zat yang terbentuk adalah 1 mol
- wujud zat diukur pada keadaan entalpi standar, yaitu tekanan 1 atm dan suhu 25°C
2. ΔH° Penguraian \((\Delta H_d^o)\)
Energi yang menyertai penguraian 1 mol senyawa menjadi unsur-unsurnya pada tekanan 1 atm dan suhu 25°C.
ΔH° penguraian merupakan kebalikan dari ΔH° pembentukan, sehingga nilai ΔH° penguraian sama dengan nilai ΔH° pembentukan hanya berbeda tanda.
Contoh:
(1) \(\ce{ CH4(g) -> C(s) + 2 H2(g)\quad \Delta H_d^o = 74.9 kJ/mol} \)
(2) \(\ce{H2O(l) -> H2(g) + \frac{1}{2} O2(g) \quad \Delta H_d^o = 285.8 kJ/mol}\)
(3) \(\ce{NH3(g) -> \frac{1}{2} N2(g) + \frac{3}{2} H2(g) \quad \Delta H_d^o = 46.1 kJ/mol}\)
3. ΔH° Pembakaran \((\Delta H_c^o)\)
Energi yang menyertai pembakaran 1 mol zat pada tekanan 1 atm dan suhu 25°C.
Pembakaran suatu zat disertai dengan reaksi zat tersebut dengan gas oksigen.
Contoh:
(1) \(\ce{H2(g) + \frac{1}{2} O2(g) -> H2O(l) \quad \Delta H_c^o = -285.8 kJ/mol}\)
(2) \(\ce{ CH4(g) + O2(g) -> CO2(g) + 2 H2O (l) \quad \Delta H_c^o = 890 kJ/mol}\)
4. ΔH° Penetralan
Energi yang menyertai penetralan asam dan basa, dan membentuk 1 mol air pada keadaan standar yang ditetapkan, biasanya pada tekanan 1 atm dan suhu 25°C.
Contoh:
(1) \(\ce{HCl(aq) + NaOH(aq) -> NaCl(aq) + H2O(l)}\)
(2) \(\ce{\frac{1}{2} H2SO4(aq) + \frac{1}{2} Ba(OH)2(aq) -> \frac{1}{2} BaSO4(aq) + H2O(l) }\)
5. ΔH° Pelarutan
Energi yang menyertai pelarutan zat pada tekanan 1 atm.
Contoh:
(1) \(\ce{CaCO3(s) -> CaCO3(aq)}\)
Bisa juga ditulis dengan \(\ce{CaCO3(s) -> Ca^{2+}(aq) + CO3^{2-}(aq)}\)
Karena perubahan entalpi standar \((\Delta H^o)\) diukur untuk 1 mol zat,
dapat digunakan rumus sebagai berikut:
\(\Delta H = \dfrac{Q}{n}\)
Q = jumlah kalor dan n = jumlah mol
\(\Delta H\) suatu reaksi dapat ditentukan dengan menggunakan data \(\Delta H_f\) senyawa-senyawa dalam reaksi tersebut.
\(\Delta H_{\text{reaksi}} = \Delta H_{f\text{ produk}} - \Delta H_{f\text{ reaktan}}\)
Khusus \(∆H_f \: \text{unsur} = 0\)
SOAL LATIHAN

