INDIKATOR ASAM BASA
Titrasi asam basa adalah prosedur yang dilakukan untuk menentukan kosentrasi (molaritas) suatu asam atau basa berdasarkan reaksi netralisasi.
A. Reaksi netralisasi
Reaksi netralisasi adalah reaksi antara asam dan basa dimana keduanya habis bereaksi. Jumlah mol ion \(\ce{H+}\) sama dengan jumlah mol ion \(\ce{OH-}\).
\(\text{mol} \: \ce{H+} = \text{mol} \: \ce{OH-}\)
\(a \:.\: \text{V}_{\text{Asam}} \:.\: \text{M}_{\text{Asam}} = b \:.\: \text{V}_{\text{Basa}} \:.\: \text{M}_{\text{Basa}}\)
\(a\) adalah jumlah ion \(\ce{H+}\) pada molekul asam
\(b\) adalah jumlah ion \(\ce{OH-}\) pada molekul basa
B. Kurva titrasi
Basa kuat dititrasi oleh asam kuat
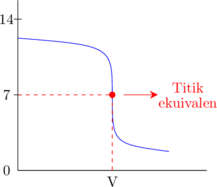
Asam kuat dititrasi oleh basa kuat
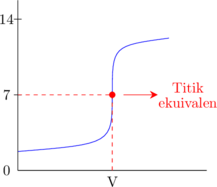
Basa lemah dititrasi oleh asam kuat
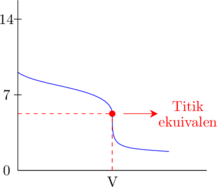
Asam kuat dititrasi oleh basa lemah
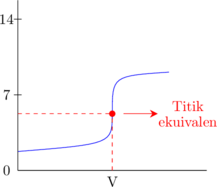
Basa kuat dititrasi oleh asam lemah
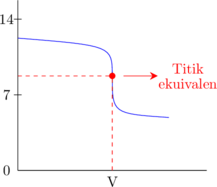
Asam lemah dititrasi oleh basa kuat
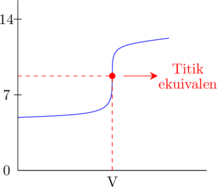
Basa lemah dititrasi oleh asam lemah
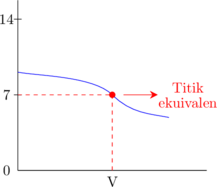
Asam lemah dititrasi oleh basa lemah
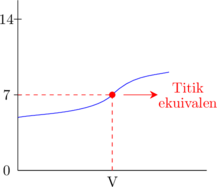
C. Pemilihan indikator yang sesuai
Indikator yang sesuai apabila perubahan warna terjadi pada daerah perubahan pH yang drastis.
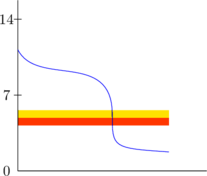
Indikator di samping sudah sesuai karena perubahan warna terjadi pada perubahan pH yang drastis.
Titik equivalen terjadi saat warna orange pertama kali muncul.
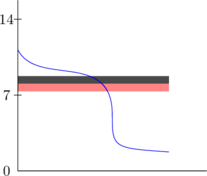
Indikator di samping tidak sesuai karena perubahan warna terjadi sebelum terjadi perubahan pH yang drastis.
SOAL LATIHAN
